
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Основания — классификация, получение и свойства.
Основания — классификация, получение и свойства.
Основанияминазывают гидроксиды, которые диссоциируют (распадаются) на гидроксильную группу и положительно заряженный катион.
Общая формула оснований — Э(OН)m, где m – степень окисления металла.
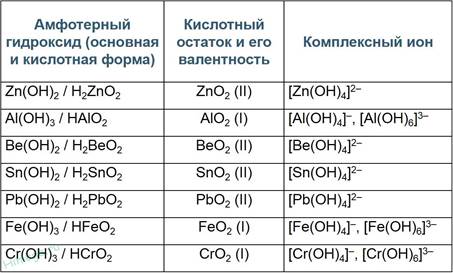
Амфотерными называют гидроксиды,которые могут проявлять свойства кислоты и основания.
К амфотерным относятся следующие гидроксиды: - большинство гидроксидов d-элементов (хрома(III), железа, цинка, и др.); - ряд гидроксидов p-элементов (алюминия, галлия, олова, свинца и др.); - из гидроксидов s-элементов амфотерным является гидроксид бериллия;
Получение оснований
Взаимодействие активных металлов с водой (только щелочи)
2Na + 2H2O = 2NaOH + H2,
Ba + 2H2O = Ba(OH)2 + H2,
Взаимодействие основных оксидов с водой (только щелочи)
Na2O + H2O = 2NaOH,
Взаимодействие солей со щелочами (малорастворимые основания)
CuSO4 + 2NaOH = Cu(OH)2↓+ Na2SO4,
Cu2+ + 2OH— = Cu(OH)2,
AlCl3 + 3NaOH = Al(OH)3↓ + 3NaCl,
Al3+ + 3OH— = Al(OH)3.
Электролиз водных растворов солей (промышленный способ)
2NaCl + 2H2O = 2NaOH + H2 + Cl2.
Химические свойства оснований
1) Растворы оснований мыльные на ощупь.
В водном растворе растворимые основания диссоциируют, образуя катион металла и гидроксогруппу: Многоосновные основания диссоциируют ступенчато:
| NaOH = Na+ + OH— | Ba(OH)2 = BaOH+ + OH— BaOH+ = Ba2+ + OH— Ba(OH)2 = Ba2+ + 2OH—. |
2) Взаимодействие с кислотами (реакция нейтрализации)
NaOH + HCl = NaCl + H2O, OH— + H+ = H2O. При реакции нейтрализации взаимодействие сводится к взаимодействию ионов водорода и гидроксогруппы с образованием малодиссоциирующего вещества – воды. Многоосновные основания образуют основные и средние соли: Ba(OH)2 + HCl = BaOHCl + H2O, Ba(OH)2 + 2HCl = BaCl2 + 2H2O. 3) Взаимодействие с кислотными оксидами
Ca(OH)2 + CO2 = CaCO3 + H2O, 4) Взаимодействие с солями Fe2(SO4)3 + 6NaOH = 2Fe(OH)3 + 3Na2SO4, 2Fe3+ + 6OH— = 2Fe(OH)3. 5) Термическое разложение Cu(OH)2 = CuO + H2O, 2Fe(OH)3 = Fe2O3 + 3H2O . Щелочи термическому разложению не подвергаются, например, гидроксид натрия кипит при 1400°С без разложения, из всех растворимых оснований разлагается только гидроксид лития: 2LiOH = Li2O + H2O. 6)Взаимодействие с неметаллами 6KOH + 3S = K2SO3 + 2K2S + 3H2O, 2NaOH + Cl2 = NaCl + NaOCl + H2O (на холоде).
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|