
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Выполните задания в тетради и отправьте : вк ( только домашнее задание перед уроком (можно раньше).
9 класс. Химия на урок 19.11.20г
Ребята, здравствуйте.
Выполните задания в тетради и отправьте : вк ( только домашнее задание перед уроком (можно раньше).
Записывайте число и тему урока. Пишите разборчиво. особенно уравнения реакций . Основной материал дан в конспекте урока( только переписать) Конспекты пригодятся для контрольной работы.
Тема урока: Серная кислота. Окислительные свойства концентрированной серной кислоты.
параграф № 13
Прочитать и запомнить
Сначала -вода,
Затем –кислота
Иначе случится беда!
Работать с серной кислотой следует очень осторожно. Серная кислота вызывает сильные ожоги кожи. Поэтому при работе с ней нужно строго соблюдать правила техники безопасности.
СЕРНАЯ КИСЛОТА - H2SO4
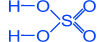
Физические свойства
Тяжелая маслянистая жидкость ("купоросное масло"); r= 1,84 г/см3; нелетучая, хорошо растворима в воде – с сильным нагревом; t°пл. = 10,3°C, t°кип. = 296°С,
Химические свойства серной кислоты
H2SO4 - сильная двухосновная кислота, водный раствор изменяет окраску индикаторов (лакмус и универсальный индикатор краснеют)
Диссоциация протекает ступенчато:
H2SO4→ H+ + HSO4- (первая ступень, образуется гидросульфат – ион)
HSO4- → H+ + SO42- (вторая ступень, образуется сульфат – ион)
H2SO4 образует два ряда солей - средние (сульфаты) и кислые (гидросульфаты)
Взаимодействие с металлами:
Разбавленная серная кислота растворяет только металлы, стоящие в ряду напряжений левее водорода:
Zn0 + H2+1SO4(разб) → Zn+2SO4 + H20↑
Zn0 + 2H+ → Zn2+ + H20↑
Взаимодействие с основными и амфотерными оксидами:
CuO + H2SO4 → CuSO4 + H2O
CuO + 2H+ → Cu2+ + H2O
Взаимодействие с основаниями:
H2SO4 + 2NaOH → Na2SO4 + 2H2O (реакция нейтрализации)
H+ + OH- → H2O
Если кислота в избытке, то образуется кислая соль:
H2SO4 + NaOH → NaНSO4 + H2O
H2SO4 + Cu(OH)2 → CuSO4 + 2H2O
2H+ + Cu(OH)2 → Cu2+ + 2H2O
образование газа -как сильная нелетучая кислота серная вытесняет из солей другие менее сильные кислоты, например, угольную
MgCO3 + H2SO4 → MgSO4 + H2O + CO2↑
MgCO3 + 2H+ → Mg2+ + H2O + CO2↑
Качественная реакция на сульфат-ион:
Образование белого осадка BaSO4 (нерастворимого в кислотах) используется для идентификации серной кислоты и растворимых сульфатов. Ион бария реактив на сульфат –ион.
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
Ba2+ + SO42- → BaSO4↓
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|