
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Валентность показывает, сколько атомов может присоединить элемент посредством ковалентных связей.
11 класс. Химия ( профиль) на урок 18.11.20г
Ребята, здравствуйте.
Записывайте число и тему урока. ( отправлять на проверку не надо,
надеюсь на вашу сознательность).
Тема урока: Валентные возможности атомов химических элементов.
Задания:
· Проработать конспект урока и параграф №5
· Выполнить основные записи ((пригодятся для контрольной работы ).
· Выполнить задания в конце конспекта .
.
Валентность – это количество ковалентных связей, которое образует атом в соединении с ковалентной связью.
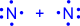
| 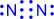
| Валентность азота равна III, т.к. азот образует три связи |
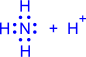
| 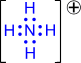
| Валентность азота равна IV, т.к. азот образует четыре связи |
Валентность атома химического элемента не может быть выше полного числа орбиталей на внешнем уровне этого элемента.
Чтобы оценить валентные возможности атомов химических элементов, необходимо подробно рассмотреть распределение электронов на энергетических уровнях.
Валентность соответствует числу неспаренных электронов, располагающихся на s- и р-орбиталях внешнего энергетического уровня. Валентные электроны атомов элементов, входящих в побочные группы периодической таблицы, располагаются на s-орбитали внешнего уровня и d-орбиталях, образующих внешний подуровень.
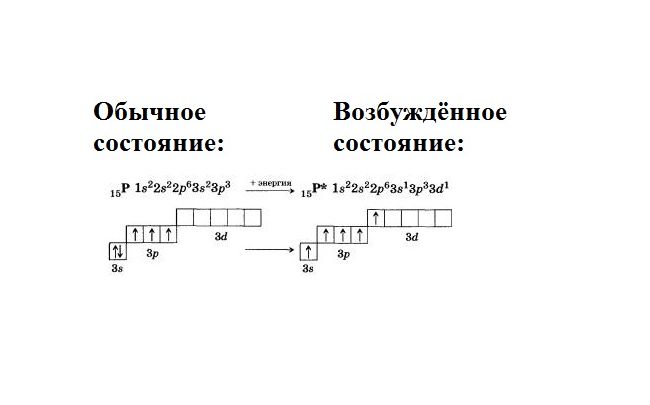
В обычном (стационарном) состоянии электроны занимают определённое положение в атоме. Стационарная электронная конфигурация зафиксирована в таблице Менделеева. При возбуждённом состоянии (реакции с другими элементами) энергия атома перераспределяется, и электроны меняют своё положение.
Рассмотрим пример. Атом фосфора в стационарном положении имеет электронную конфигурацию 1s22s22p63s23p3.
Это значит, что 15 электронов распределены по трём уровням. На внешнем уровне, включающем s- и p-орбитали, находятся пять валентных электронов. При этом три электрона на p-орбитали неспаренные, а два электрона на s-орбитали образуют пару. Соответственно, три неспаренных электрона могут образовывать ковалентные связи, и валентность фосфора равна трём.
Фосфор находится в V группе, главной подгруппе. Это значит, что в атоме находится пустой d-подуровень. В возбуждённом состоянии спаренные электроны s-уровня распариваются, и один электрон переходит на d-подуровень. Образуется пять свободных, неспаренных электронов. Соответственно, атом фосфора приобретает пятую валентность.
Вывод:
· Валентность показывает, сколько атомов может присоединить элемент посредством ковалентных связей.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|