
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Тема занятия: Решение задач на определение основных параметров идеального газа
Тема занятия: Решение задач на определение основных параметров идеального газа
При решении задач по данной теме надо чётко представлять себе начальное состояние системы и какой процесс переводит её в конечное состояние. Одна из типичных задач на использование уравнения состояния идеального газа: требуется определить параметры системы в конечном состоянии по известным макроскопическим параметрам в её начальном состоянии.
Задача1. Воздух состоит из смеси газов (азота, кислорода и т. д.). Плотность воздуха ρ0 при нормальных условиях (температура t0 = 0 °С и атмосферное давление р0 = 101 325 Па) равна 1,29 кг/м3. Определите среднюю (эффективную) молярную массу М воздуха.
Р е ш е н и е.
Уравнение состояния идеального газа при нормальных условиях имеет вид 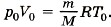
Здесь R = 8,31 Дж/(моль • К) и Т0 = 0 °С + 273 °С = 273 К, М — эффективная молярная масса воздуха. Эффективная молярная масса смеси газов — это молярная масса такого воображаемого газа, который в том же объёме и при той же температуре оказывает на стенки сосуда то же давление, что и смесь газов, в данном случае воздух. Отсюда
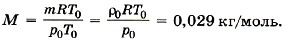
Задача2.
Определите температуру кислорода массой 64 г, находящегося в сосуде объёмом 1 л при давлении 5 • 106 Па.
Молярная масса кислорода М = 0,032 кг/моль.
Р е ш е н и е.
Согласно уравнению Менделеева—Клапейрона
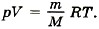
Отсюда температура кислорода 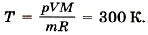
Задача3. Определите плотность азота при температуре 300 К и давлении 2 атм. Молярная масса азота М = 0,028 кг/моль.
Р е ш е н и е.
Запишем уравнение Менделеева—Клапейрона:
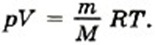
Разделив на объём левую и правую части равенства, получим
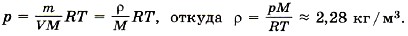
Задача4. Определите, на сколько масса воздуха в комнате объёмом 60 м3 зимой при температуре 290 К больше, чем летом при температуре 27 °С. Давление зимой и летом равно 105 Па.
Р е ш е н и е.
Запишем уравнение Менделеева—Клапейрона:
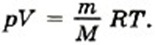
Из этого уравнения выразим массу газа:
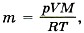
где T принимает значения Т1 и Т2 — температуры воздуха зимой и летом.
Молярная масса воздуха М = 0,029 кг/моль. Температура воздуха летом Т2 = 27 °С + 273 °С = 300 К.
Таким образом,
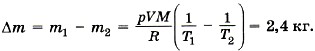
Домашнее задание:
1. Разобрать задачи
2. Решите задачи:
1. Баллон емкостью 0,0831 м3 содержит 1,6 кг кислорода. При какой температуре баллон может разорваться, если он выдерживает давление 2 • 106 Па?
2. Баллон, наполненный газом под давлением 2,84 МПа, находился на складе при температуре 7 °С. После того как половину газа израсходовали, баллон внесли в помещение. Какова температура в помещении, если давление газа в баллоне через некоторое время стало 1,52 МПа?
3. Определите массу углекислого газа, находящегося в баллоне емкостью 5 • 10–2 м3 при температуре 300 К. Давление газа 3 • 106 Па
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|