
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Алюминий. Соединения алюминия.
Алюминий. Соединения алюминия.
I. Алюминий –простое вещество.
1. Порошкообразный алюминий легко взаимодействует с неметаллами
4Al + 3O2 = 2Al2O3 2Al + N2 = 2AlN 4Al + 3C  Al4C3
Al4C3
2. Очищенный от оксидной пленки алюминий способен взаимодействовать с водой: 2Al + 6H2O = 2Al(OH)3 + 3H2
3. Алюминий восстанавливает металлы из их оксидов (алюмотермия)
2Al + Cr2O3 = Al2O3 + 2Cr8Al + 3Fe3O4 = 4Al2O3 + 9Fe
4. Как активный металл алюминий реагирует с растворами кислот с выделением водорода:
2Al + 6HCl = 2AlCl3 + 3H22Al + 3H2SO4(разб.)= Al2(SO4)3 + 3H2
Концентрированные серная и азотная кислоты на холоду пассивируют алюминий, однако, при сильном нагревании они растворяют алюминий.
2Al + 6H2SO4(конц.) 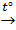 Al2(SO4)3 + 3SO2 + 6H2O
Al2(SO4)3 + 3SO2 + 6H2O
Al + 6HNO3(конц..) 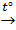 Al(NO3)3 + 3NO2 + 3H2O
Al(NO3)3 + 3NO2 + 3H2O
10Al + 36HNO3(разб.) = 10Al(NO3)3 + 3N2 + 48H2O
8Al + 30HNO3(разб.)= 8Al(NO3)3 + 3N2O + 15H2O
8Al + 30HNO3(оч. разб.)= 8Al(NO3)3 + 3NH4NO3 + 9H2O
5. При нагревании с концентрированными растворами щелочей алюминий образует комплексные соли.
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
2Al + 6NaOH 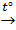 2Na3AlO3 + 3H2 (сплавление)
2Na3AlO3 + 3H2 (сплавление)
6. Взаимодействие со сложными веществами
2Al + 3Na2O2 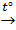 2NaAlO2 + 2Na2O
2NaAlO2 + 2Na2O
8Al + 3KNO3 + 5KOH + 18H2O = 8K[Al(OH)4] + 3NH3
10Al + 6KMnO4 + 24H2SO4 = 5Al2(SO4)3 + 6MnSO4 + 3K2SO4 + 24H2O
2Al + NaNO2 + NaOH + 5H2O = 2Na[Al(OH)4] + NH3
Al + 3KMnO4 + 4KOH = 3K2MnO4 + K[Al(OH)4]
4Al + K2Cr2O7 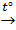 2Cr + 2KAlO2 + Al2O3
2Cr + 2KAlO2 + Al2O3
II. Cоединения алюминия.
1) Оксид алюминия – типичный представитель амфотерных оксидов.Он взаимодействует и с кислотами, и с щелочами, с кислотными и основными оксидами:
Al2O3 + 6HCl = 2AlCl3 + 3H2O
Al2O3 + 3H2SO4 = Al2(SO4)3 + 3H2O
Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4]
При сплавлении оксида алюминия с щелочами образуется метаалюминат.
Al2O3 + 2NaOH 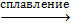 2NaAlO2 + H2O
2NaAlO2 + H2O
Al2O3 + 2KOH 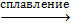 2KAlO2 + H2O
2KAlO2 + H2O
Al2O3 + 3N2O5 = 2Al(NO3)3
Al2O3 +K2O  2KAlO2
2KAlO2
В соответствующие соли оксид алюминия можно перевести с помощью солей, кислотные или основные свойства которых выражены в меньшей степени:
Al2O3 + 6KHSO4 = Al2(SO4)3 + 3K2SO4 + 3H2O
Al2O3 + Na2CO3  2NaAlO2 + CO2
2NaAlO2 + CO2
Al2O3 + 3CaH2  3CaO + 2Al + 3H2
3CaO + 2Al + 3H2
2Al2O3 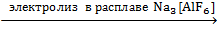 4Al+ 3O2 (получение алюминия)
4Al+ 3O2 (получение алюминия)
на катоде на аноде
2) Гидроксид алюминия проявляет амфотерные свойства:
ПолучениеAl2(SO4)3 + 6(NH3 ∙ H2O) = 2Al(OH)3↓ + 3(NH4)2SO4 (
AlCl3 + 3(NH3 ∙ H2O) = Al(OH)3 + 3NH4Cl
Al(OH)3 + NaOH = Na[Al(OH)4]Al(OH)3 + NaOH 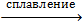 NaAlO2 + 2H2O
NaAlO2 + 2H2O
Al(OH)3 + 3HCl = AlCl3 + 3H2O2Al(OH)3 + 3H2SO4 = Al2(SO4)3 + 6H2O
Гидроксид алюминия термически неустойчив:2Al(OH)3  Al2O3 + 3H2O
Al2O3 + 3H2O
3) Соли.
Na[Al(OH)4] + CO2 = Al(OH)3↓ + NaHCO3
Na[Al(OH)4] + SO2 = Al(OH)3↓ + NaHSO3
Na[Al(OH)4] + 4HCl(избыток) = NaCl + AlCl3 + 4H2O
Na[Al(OH)4] + НCl(недостаток) = Al(OH)3↓ + NaCl + H2O
Na[Al(OH)4] + HNO3(недостаток) = Al(OH)3↓ + NaNO3 + H2O
2Na[Al(OH)4] + Cl2 = 2Al(OH)3↓ + NaCl + NaClO
AlCl3 + 3Na[Al(OH)4] = 4Al(OH)3↓ + 3NaCl
Na[Al(OH)4]  NaAlO2 + 2H2O↑
NaAlO2 + 2H2O↑
2AlCl3 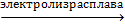 2Al + 3Cl2
2Al + 3Cl2
на катоде на аноде
4Al(NO3)3  2Al2O3 + 12NO2 + 3O2
2Al2O3 + 12NO2 + 3O2
2Al2(SO4)3  2Al2O3 + 6SO2 + 3O2
2Al2O3 + 6SO2 + 3O2
Al2(SO4)3 + 6NaHSO3 = 2Al(OH)3 + 6SO2 + 3Na2SO4
Al(NO3)3 + 4KOH(избыток) = K[Al(OH)4] + 3KNO3
Al(NO3)3 + 3(NH3 ∙ H2O) = Al(OH)3↓ + 3NH4Cl
AlCl3 + 3(NH3 ∙ H2O) = Al(OH)3 + 3NH4Cl
Al2(SO4)3 + 6(NH3 ∙ H2O) = 2Al(OH)3↓ + 3(NH4)2SO4
Al2(SO4)3 + 6NaOH (недостаток) = 2Al(OH)3↓ + 3Na2SO4
Al2(SO4)3 + 8NaOH(избыток) = 2Na[Al(OH)4] + 3Na2SO4
AlCl3 + 3NaOH(недостаток) = Al(OH)3↓ + 3NaCl
Al(NO3)3 + 4KOH  KAlO2 + 3KNO3 + 2H2O
KAlO2 + 3KNO3 + 2H2O
KAlO2 + H2O = K[Al(OH)4]
NaAlO2 + 2H2O = Na[Al(OH)4]
Гидролиз солей алюминия и по катиону слабого основания, и по аниону слабой кислоты:
2AlBr3 + 3Na2CO3 + 3H2O = 2Al(OH)3↓ + CO2↑ + 6NaBr
2AlCl3 + 3Na2S + 6H2O = 2Al(OH)3 + 3H2S↑ + 6NaCl
2) Бинарные соединения.
Al2 S3 + 8HNO3 = Al2(SO4)3 + 8NO2 + 4H2O
Al2 S3 + 30HNO3(конц.гор.)= 2Al(NO3)3 + 24NO2 + 3H2SO4 + 12H2O
Al2S3 +6H2O = 2Al(OH)3↓ + 3H2S↑
Al4C3 + 12H2O = 4Al(OH)3 + 3CH4
AlN + 3HCl = AlCl3 + NH3
AlN + 3H2O = Al(OH)3↓ + NH3
Алюминий. Соединенияалюминия
1. В раствор, полученный при взаимодействии алюминия с разбавленной серной кислотой, по каплям добавили раствор гидроксида натрия до образования осадка. Выпавший осадок белого цвета отфильтровали и прокалили. Полученное вещество сплавили с карбонатом натрия. Напишите уравнения описанных реакций.
2. К раствору сульфата алюминия добавили избыток гидроксида натрия. В полученный раствор небольшими порциями прибавили соляную кислоту, при этом наблюдали образование объемного осадка белого цвета, который растворился при дальнейшем прибавлении кислоты. В образовавшийся раствор прилили раствор карбоната натрия. Напишите уравнения описанных реакций.
3. Газ, выделившийся при взаимодействии хлористого водорода с перманганатом калия, пропустили через раствор тетрагидроксоалюмината натрия. Образовавшийся осадок отфильтровали, прокалили, и твердый остаток обработали соляной кислотой. Напишите уравнения описанных реакций.
4. Твердое вещество, образовавшееся при взаимодействии сернистого газа и сероводорода, при нагревании взаимодействует с алюминием. Продукт реакции растворили в разбавленной серной кислоте и в образовавшийся раствор добавили поташ. Напишите уравнения описанных реакций.
5. Продукт взаимодействия серы с алюминием (реакция протекает при нагревании) растворили в холодной разбавленной серной кислоте и в раствор добавили карбонат калия. Образовавшийся осадок отделили, смешали с едким натром и нагрели. Напишите уравнения описанных реакций.
6. К раствору кальцинированной соды добавили раствор хлорида алюминия, выделившееся вещество отделили и внесли в раствор едкого натра. В образовавшийся раствор по каплям прибавляли раствор хлороводородной кислоты до прекращения образования осадка, который отделили и прокалили. Напишите уравнения описанных реакций.
7. Нитрат алюминия прокалили, продукт реакции смешали с кальцинированной содой и нагрели до плавления. Образовавшееся вещество растворили в азотной кислоте и полученный раствор нейтрализовали раствором аммиака, при этом наблюдали выделение объемного студенистого осадка. Напишите уравнения описанных реакций.
8. Осадок, полученный при добавлении в раствор сульфата алюминия каустической соды, отделили, прокалили, смешали с кальцинированной содой и нагрели до плавления. После обработки остатка серной кислотой была получена исходная соль алюминия. Напишите уравнения описанных реакций.
9. В раствор кристаллической соды добавили хлорид алюминия, выделившийся осадок отделили и обработали раствором едкого натра. Полученный раствор нейтрализовали азотной кислотой, выделившийся осадок отделили и прокалили. Напишите уравнения описанных реакций.
10. Осадок, полученный при взаимодействии раствора соли алюминия и щелочи, прокалили. Продукт реакции растворили в концентрированном горячем растворе щелочи. Через полученный раствор пропустили углекислый газ, в результате чего образовался осадок. Напишите уравнения описанных реакций.
11. Вещество, которое образуется при электролизе расплава боксита в криолите, растворяется как в растворе соляной кислоты, так и в растворе щелочи с выделением одного и того же газа. При смешивании полученных растворов образуется объемный осадок белого цвета. Напишите уравнения описанных реакций.
12. Навеску алюминия растворили в разбавленной азотной кислоте, при этом выделилось газообразное простое вещество. К полученному раствору добавили карбонат натрия до полного прекращения выделения газа. Выпавший осадок отфильтровали и прокалили. Фильтрат упарили, полученный твердый остаток сплавили с хлоридом аммония. Выделившийся газ смешали с аммиаком и нагрели полученную смесь. Напишите уравнения описанных реакций
13. Оксид алюминия сплавили с карбонатом натрия, полученное твердое вещество растворили в воде. Через полученный раствор пропускали сернистый газ до полного прекращения взаимодействия. Выпавший осадок отфильтровали, а к профильтрованному раствору прибавили бромную воду. Полученный раствор нейтрализовали гидроксидом натрия. Напишите уравнения описанных реакций.
14. Навеску сульфида алюминия обработали соляной кислотой. При этом выделился газ и образовался бесцветный раствор. К полученному раствору добавили раствор аммиака, а газ пропустили через раствор нитрата свинца. Полученный при этом осадок обработали раствором пероксида водорода. Напишите уравнения описанных реакций.
15. Порошок алюминия смешали с порошком серы, смесь нагрели, полученное вещество обработали водой, при этом выделился газ и образовался осадок, к которому добавили избыток раствора гидроксида калия до полного растворения. Этот раствор выпарили и прокалили. К полученному твердому веществу добавили избыток раствора соляной кислоты. Напишите уравнения описанных реакций.
16. Газ, выделившийся при взаимодействии хлористого водорода с бертолетовой молью, внесли в реакцию с алюминием. Продукт реакции растворили в воде и добавили гидроксид натрия до прекращения выделения осадка, который отделили и прокалили. Напишите уравнения описанных реакций.
17. Газ, выделившийся при нагревании раствора хлористого водорода с оксидом марганца (IV), внесли во взаимодействие с алюминием. Продукт реакции растворили в воде и добавили сначала избыток раствора гидроксида натрия, а затем соляную кислоту. Напишите уравнения описанных реакций.
18. Металлический алюминий растворили в растворе гидроксида натрия. Через полученный раствор пропустили избыток углекислого газа. Выпавший осадок прокалили, и полученный продукт сплавили с карбонатом натрия. Напишите уравнения описанных реакций.
19) Оксид алюминия сплавили с содой. Полученный продукт растворили в соляной кислоте и обработали избытком аммиачной воды. Выпавший осадок растворили в избытке раствора гидроксида калия. Напишите уравнения описанных реакций.
20) Оксид алюминия сплавили с гидроксидом натрия. Продукт реакции внесли в раствор хлорида аммония. Выделившийся газ с резким запахом поглощен серной кислотой. Образовавшуюся среднюю соль прокалили. Напишите уравнения описанных реакций.
21) Порошок алюминия нагрели с порошком серы, полученное вещество обработали водой. Выделившийся при этом осадок обработали избытком раствора гидроксида калия до его полного растворения. К полученному раствору добавили раствор хлорида алюминия и вновь наблюдали образование белого осадка. Напишите уравнения описанных реакций.
22) Осадок, полученный при взаимодействии растворов сульфата алюминия и нитрата бария, отфильтровали. Фильтрат обработали едким натром в мольном соотношении 1 : 3. Выпавший осадок отделили и прокалили. Полученное вещество обработали избытком раствора соляной кислоты. Напишите уравнения описанных реакций.
23) При взаимодействии раствора сульфата алюминия с раствором сульфида калия выделился газ, который пропустили через раствор гексагидроксоалюмината калия. Образовавшийся осадок отфильтровали, промыли, просушили и нагрели. Твердый остаток сплавили с едким натром. Напишите уравнения описанных реакций.
24) Алюминиевый порошок смешали с серой и нагрели. Полученное вещество поместили в воду. Образовавшийся осадок разделили на две части. К одной части прилили соляную кислоту, а к другой – раствор гидроксида натрия. Напишите уравнения описанных реакций.
25) Металлический алюминий растворили в растворе гидроксида натрия. Через полученный раствор пропустили избыток углекислого газа. Выпавший осадок прокалили и полученный продукт растворили в разбавленной серной кислоте. Напишите уравнения описанных реакций.
26) При взаимодействии оксида алюминия и азотной кислоты образовалась соль. Соль высушили и прокалили. Образовавшийся при прокаливании остаток подвергли электролизу в расплавленном криолите. Полученный металл нагрели с концентрированными гидроксида калия и нитрата калия. При этом выделился газ с резким запахом. Напишите уравнения описанных реакций.
27) К раствору гидроксида натрия добавили порошок алюминия. Через раствор полученного вещества пропустили избыток углекислого газа. Выпавший осадок отделили и прокалили. Полученный продукт сплавили с карбонатом натрия. Напишите уравнения описанных реакций.
28) Порошок металлического алюминия смешали с твердым иодом, и добавили несколько капель воды. К полученной соли добавили раствор гидроксида натрия до выпадения осадка. Образовавшийся осадок растворили в соляной кислоте. При последующем добавлении раствора карбоната натрия вновь наблюдается выпадение осадка. Напишите уравнения описанных реакций.
29) Алюминий растворили в соляной кислоте. К полученному раствору добавили избыток раствора карбоната калия. Выпавший осадок растворили в избытке раствора едкого калия, а выделившийся газ пропустили над раскаленным углем. Напишите уравнения описанных реакций.
30) Алюминий растворили в водном растворе горячего гидроксида натрия. к полученному раствору добавили по каплям разбавленную соляную кислоту до прекращения выпадения осадка. Выделившийся в период реакции газ пропустили над раскаленным оксидом меди (II). Полученное простое вещество растворили в разбавленной азотной кислоте. Напишите уравнения описанных реакций.
Алюминий. Соединения алюминия
1) 2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑
Al2(SO4)3 + 6NaOH(недостаток) = 2Al(OH)3↓ + 3Na2SO4
2Al(OH)3  Al2O3 + 3H2OAl2O3 + Na2CO3
Al2O3 + 3H2OAl2O3 + Na2CO3  2NaAlO2 + CO2↑
2NaAlO2 + CO2↑
2) Al2(SO4)3 + 8NaOH(избыток) = 2Na[Al(OH)4] + 3Na2SO4
Na[Al(OH)4] + НCl(недостаток) = Al(OH)3↓ + NaCl + H2O
Al(OH)3 + 3НCl = AlCl3 + 3H2O
2AlCl3 + 3Na2CO3 + 3H2O = 2Al(OH)3↓ + 6NaCl + 3CO2↑
3) 2KMnO4 + 16HCl = 2MnCl2 + 5Cl2↑ + 2KCl + 8H2O
2Na[Al(OH)4] + Cl2 = 2Al(OH)3↓ + NaCl + NaClO + Н2О
2Al(OH)3  Al2O3 + 3H2OAl2O3 + 6HCl = 2AlCl3 + 3H2O
Al2O3 + 3H2OAl2O3 + 6HCl = 2AlCl3 + 3H2O
4) SO2 + 2H2S = 3S↓ + 2H2O2Al + 3S = Al2S3
Al2S3+ H2SO4 = Al2(SO4)3 + H2S↑
Al2(SO4)3 + 3K2CO3 + 3H2O = 2Al(OH)3↓ + 3CO2↑ + 3K2SO4
5) 2Al + 3S 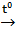 Al2S3Al2S3 + 3H2SO4 = Al2(SO4)3 + 3H2S↑
Al2S3Al2S3 + 3H2SO4 = Al2(SO4)3 + 3H2S↑
Al2(SO4)3 + 3K2CO3 + 3H2O = 2Al(OH)3↓ + 3CO2↑ + 3K2SO4
Al(OH)3 + NaOH 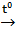 NaAlO2 + 2H2O
NaAlO2 + 2H2O
6) 2AlCl3 + 3Na2CO3 + 3H2O = 2Al(OH)3↓ + 6NaCl + 3CO2↑
Al(OH)3 + NaOH = Na[Al(OH)4]
Na[Al(OH)4] + HCl(недостаток) = Al(OH)3↓ + NaCl + H2O2Al(OH)3  Al2O3 + 3H2O
Al2O3 + 3H2O
7) 4Al(NO3)3  2Al2O3 + 12NO2↑ + 3O2↑
2Al2O3 + 12NO2↑ + 3O2↑
Al2O3 + Na2CO3  2NaAlO2 + CO2↑
2NaAlO2 + CO2↑
NaAlO2 + 4HNO3 = Al(NO3)3 + NaNO3 + 2H2O
Al(NO3)3 + 3(NH3 ∙ H2O) = Al(OH)3↓ + 3NH4Cl
8) Al2(SO4)3 + 6NaOH = 2Al(OH)3↓ + 3Na2SO42Al(OH)3  Al2O3 + 3H2O
Al2O3 + 3H2O
Al2O3 + Na2CO3  2NaAlO2 + CO2↑
2NaAlO2 + CO2↑
2NaAlO2 + 4H2SO4 = Al2(SO4)3 + Na2SO4 + 4H2O
9) 2AlCl3 + 3Na2CO3 + 3H2O = 2Al(OH)3↓ + 6NaCl + 3CO2↑
Al(OH)3 + NaOH = Na[Al(OH)4]
Na[Al(OH)4] + HNO3(недостаток) = Al(OH)3↓ + NaNO3 + H2O
2Al(OH)3  Al2O3 + 3H2O
Al2O3 + 3H2O
10) AlCl3 + 3NaOH = Al(OH)3↓ + 3NaCl2Al(OH)3  Al2O3 + 3H2O
Al2O3 + 3H2O
Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4]
Na[Al(OH)4] + CO2 = Al(OH)3↓ + NaHCO3
11) 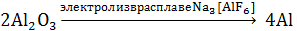 + 3O2
+ 3O2
на катоде на аноде
2Al + 6HCl = 2AlCl3 + 3H2
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
AlCl3 + 3Na[Al(OH)4] = 4Al(OH)3↓ + 3NaCl
12) 10Al + 36HNO3(разб.) = 10Al(NO3)3 + 3N2 + 48H2O
2Al(NO3)3 + 3Na2CO3 + 3H2O = 2Al(OH)3↓ + 6NaNO3 + 3CO2↑
NaNO3 + NH4Cl  NaCl + N2O + 2H2O2Al(OH)3
NaCl + N2O + 2H2O2Al(OH)3  Al2O3 + 3H2O
Al2O3 + 3H2O
13) Al2O3 + Na2CO3  2NaAlO2 + CO2NaAlO2 + 2H2O = Na[Al(OH)4]
2NaAlO2 + CO2NaAlO2 + 2H2O = Na[Al(OH)4]
Na[Al(OH)4] + SO2 = Al(OH)3↓ + NaHSO3NaHSO3 + Br2 + H2O = NaHSO4 + 2HBr
NaHSO4 +NaOH = Na2SO4 + H2O
HBr +NaOH = NaBr + H2O
14) Al2S3 + 6HCl = 2AlCl3 + 3H2S↑AlCl3 + 3(NH3 ∙ H2O) = Al(OH)3↓ + 3NH4Cl
Pb(NO3)2 + H2S = PbS↓ + 2HNO3PbS + 4H2O2 = PbSO4 + 4H2O
15) 2Al + 3S = Al2S3Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S↑
Al(OH)3 + KOH = K[Al(OH)4] K[Al(OH)4]  KAlO2 + 2H2O
KAlO2 + 2H2O
KAlO2 + 4HCl = AlCl3 + KCl + 2H2O
16) KClO3+ 6HCl = KCl + 3Cl2↑ + 3H2O2Al + 3Cl2 = 2AlCl3
AlCl3 + 3NaOH = Al(OH)3↓ + 3NaCl2Al(OH)3 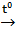 Al2O3 + 3H2O
Al2O3 + 3H2O
17) MnO2 + 4HCl = MnCl2 + Cl2↑ + 2H2O2Al + 3Cl2 = 2AlCl3
AlCl3 + 4NaOH = Na[Al(OH)4] + 3NaCl
Na[Al(OH)4] + 4HCl = AlCl3 + NaCl + 4H2O
18) 2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
Na[Al(OH)4] + CO2 = Al(OH)3↓ + NaHCO3
2Al(OH)3 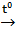 Al2O3 + 3H2OAl2O3 +Na2CO3
Al2O3 + 3H2OAl2O3 +Na2CO3 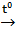 2NaAlO2 + CO2↑
2NaAlO2 + CO2↑
19) Al2O3 +Na2CO3 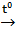 2NaAlO2 + CO2↑NaAlO2 + 4HCl = NaCl + AlCl3 + 2H2O
2NaAlO2 + CO2↑NaAlO2 + 4HCl = NaCl + AlCl3 + 2H2O
AlCl3 + 3(NH3· H2O) = Al(OH)3↓ + 3NH4ClAl(OH)3 + 3KOH = K3[Al(OH)6]
20) Al2O3 +2NaOH 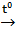 2NaAlO2 + H2O
2NaAlO2 + H2O
NaAlO2 + NH4Cl + H2O = NaCl + Al(OH)3↓ + NH3↑
2NH3 + H2SO4 = (NH4)2SO4(NH4)2SO4 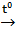 NH4HSO4 + NH3↑
NH4HSO4 + NH3↑
21) 2Al + 3S = Al2S3Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S↑
Al(OH)3 + KOH = K[Al(OH)4] допустимо образование K3[Al(OH)6]
3K[Al(OH)4] + AlCl3 = 4Al(OH)3 + 3KCl
22) Al2(SO4)3 + 3Ba(NO3)2 = 3BaSO4↓ + 2Al(NO3)3
Al(NO3)3 + 3NaOH = Al(OH)3↓ + 3NaNO3
2Al(OH)3 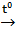 Al2O3 + 3H2O
Al2O3 + 3H2O
Al2O3 + 6HCl = 2AlCl3 + 3H2O
23) Al2(SO4)3+ 3K2S + 6H2O = 2Al(OH)3 + 3H2S↑ + 3K2SO4
3H2S + K3[Al(OH)6] = 2Al(OH)3 + 3KHS + 3H2O
2Al(OH)3 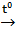 Al2O3 + 3H2O
Al2O3 + 3H2O
Al2O3 +2NaOH 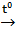 2NaAlO2 + H2O
2NaAlO2 + H2O
24) 2Al + 3S 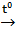 Al2S3
Al2S3
Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S↑
Al(OH)3 + 3HCl = AlCl3 + 3H2O
Al(OH)3 + NaOH = Na[Al(OH)4]
допустимо образование Na3[Al(OH)6]
25) 2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
Na[Al(OH)4] + CO2 = Al(OH)3↓ + NaHCO3
2Al(OH)3 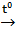 Al2O3 + 3H2O
Al2O3 + 3H2O
Al2O3 + 3H2SO4= Al2(SO4)3+3H2O
26) Al2O3 + 6HNO3 = 2Al(NO3)3 + 3H2O
4Al(NO3)3 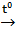 2Al2O3 + 12NO2 + 3O2
2Al2O3 + 12NO2 + 3O2
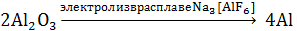 + 3O2
+ 3O2
на катоде на аноде
8Al + 3KNO3 + 5KOH + 18H2O = 3NH3 + 8K[Al(OH)4]
27) 2NaOH + 2Al + 6H2O = 2Na[Al(OH)4] + 3H2
Na[Al(OH)4] + CO2 = Al(OH)3 + NaHCO3
2Al(OH)3 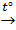 Al2O3 + 3H2O
Al2O3 + 3H2O
Al2O3 + Na2CO3 = 2NaAlO2 + CO2
28) 2Al + 3I2 = 2AlI3
AlI3 + 3NaOH = Al(OH)3 + 3NaI
Al(OH)3 + 3HCl = AlCl3 + 3H2O
2AlCl3+ 3Na2CO3 + 3H2O = 2Al(OH)3 + 3CO2 + 6NaCl
29) 2Al + 6HCl = 2AlCl3 + 3H2
2AlCl3 + 3K2CO3 + 3H2O = 2Al(OH)3 + 6KCl + 3CO2
Al(OH)3 + 3KOH = K3[Al(OH)6]
C + CO2 = 2CO
30) 2NaOH + 2Al + 6H2O = 2Na[Al(OH)4] + 3H2
Na[Al(OH)4] + 4HCl = AlCl3 + NaCl + 4H2O
CuO + H2 = Cu + H2O
3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO + 4H2O
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|