
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Олимпиадная работа по химии 9 класс
Олимпиадная работа по химии 9 класс
2018 – 2019 учебный год
Продолжительность - 90 минут
Максимальное количество баллов – 29
Задание №1.
Определите степени окисления выделенных элементов в следующих соединениях:
А) NH4NO2,
Б) Na2Cr2O7,
В) Fe3O4,
Г) Na2O2,
Д) FeNH4(SO4)2 (6 баллов)
Задание №2
Для дезинфекции помещений и отбеливания тканей используется хлорная известь. Выведите ее формулу, если известно, что массовая доля в ней кислорода - 12.6%, кальция – 31,5%, остальное приходится на элемент, упоминающийся в названии вещества. Изобразите структурную формулу этого вещества, исходя из валентностей элементов (валентность хлора принять за 1)
(5 баллов)
Задание №3
Напишите уравнения реакций, с помощью которых можно осуществить превращения и назовите вещества Х1- Х5:
S 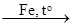 X1
X1 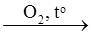 X2
X2 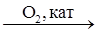 X3
X3 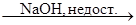 X4
X4 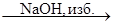 X5
X5
(5 баллов)
Задание №4
50 г смеси карбонатов бария и натрия растворили в избытке соляной кислоты. Добавление к полученному в результате реакций раствору избытка раствора сульфата натрия приводит к выпадению 46,6г осадка.
Напишите уравнения протекающих реакций и определите массовые доли (в %) карбонатов в смеси.
(7 баллов)
Задание №5
Какие из ионов не могут находиться в одном растворе? Почему?
Ba 2+; H+; CL-; OH-; SO42-.
Ответ подтвердите ионными уравнениями. Запишите не менее двух молекулярных уравнений, соответствующих каждому сокращённому ионному уравнению.
(6 баллов)
Ключ
Задание №1
а) -3, +3; б) +6; в) +8/3; г) -1; д) +3
Задание №2
Общая формула хлорной извести: CxClyOz.
x : y : z = w (Ca) : w (Cl) : w (O) = 31,5 : 55,9 : 12,6 = 1:2:1
Ar(Ca) Ar(Cl) Ar(O) 40 35,5 16
Молекулярная формула: СаCl2О
 О - Cl
О - Cl
 Структурная формула: Са
Структурная формула: Са
Cl
Задание №3
Уравнения реакций и названия веществ X1 - X5:
S + Fe = FeS (сульфид железа(II)); 4FeS + 7O2 = 2Fe2O3 + 4SO2 (оксид серы(IV));
2SO2 + O2 = 2SO3 (оксид серы(VI)); SO3 + NaOH = NaHSO4 (гидросульфат натрия);
NaHSO4 + NaOH = Na2SO4 + H2O (сульфат натрия)
Задание №4
Уравнения протекающих реакций:
BaCO3 + 2HCl = BaCl2 + CO2 + H2O (1) Na2CO3 + 2HCl = 2NaCl + CO2 + H2O (2)
BaCl2 + Na2SO4 = BaSO4 + 2NaCl (3)
По массе осадка BaSO4 и уравнениям реакций (3) и (1) определим массу BaCO3.
По уравнению реакции (3) рассчитаем количество вещества BaCl2:
n(BaCl2) = n(BaSO4) = 46,6 / 233 = 0,2 моль
По уравнению реакции (1) рассчитаем количество вещества BaCO3 и затем его массу:
n(BaCO3) = n(BaCl2) = 0,2 моль [из уравнения реакции (3)]
m(BaCO3) = 0,2 × 197 = 39,4 г
Определим массовые доли карбонатов в смеси:
w( BaCO3) = 39,4 / 50 = 0,788 или 78,8%
w(Na2CO3) = 100 – 78,8 = 21,2%
Ответ: w(BaCO3) = 78,8% w(Na2CO3) = 21,2%
Задание №5
| В одном растворе не могут находиться ионы: а) Ba2+ + SO42-= BaSO4↓. Образование осадка. BaCI2 + H2SO4 = BaSO4↓ + 2 HCI Ba(NO3)2 + Na2SO4 = BaSO4↓ + 2 NaNO3 | б) Н+ + ОН - = Н2О Образуется слабый электролит. HCI + NaOH = NaCI + H2O HNO3 + KOH = KNO3 + H2O |
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|