
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Химические свойства металлов. Взаимодействуют с неметаллами.. Mg + O2 = 2MgO.. Взаимодействие с водой.. Na + 2H2O = 2NaOH+ H2. Fe + 4H2O = Fe3O4 + 4H2. Взаимодействие с кислотами. K Ca Na Mg Al Zn Fe Ni Sn Pb H2 Cu Hg Ag Au. H2SO4(разб) + Zn = ZnSO4+ H2&#
Вспомним особенности строения атомов металлов
Химические свойства металлов
1. Взаимодействуют с неметаллами.
Например: горение магния:
2Mg + O2 = 2MgO.
2. Взаимодействие с водой.
С водой активно реагируют щелочные и щелочноземельные металлы.
2Na + 2H2O = 2NaOH+ H2
менее активные металлы
3Fe + 4H2O = Fe3O4 + 4H2
3. Взаимодействие с кислотами
с учетом правил по положению металлов в ряду напряжения
K Ca Na Mg Al Zn Fe Ni Sn Pb H2 Cu Hg Ag Au
1. Металл в ряду должен стоять до водорода (не распространяется на щелочные и щелочноземельные металлы);
2. Полученная соль должна быть растворимой;
3. Азотная и концентрированная серная кислоты реагируют с металлами по – особому.
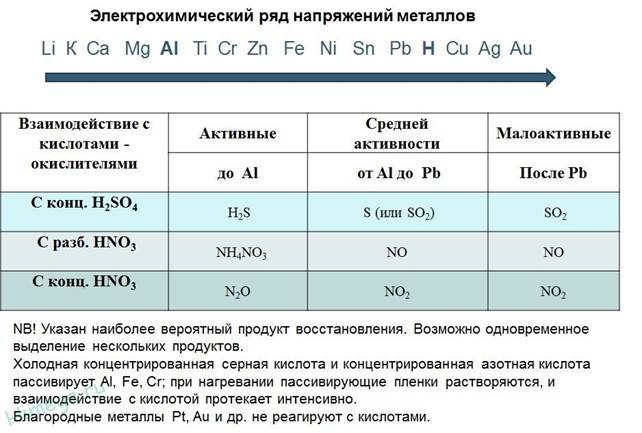
H2SO4(разб) + Zn = ZnSO4+ H2↑
H2SO4(разб) + Cu ≠
2H2SO4(конц.) + Cu = CuSO4+ 2H2O + SO2↑
Внимание!
Pt, Au+H2SO4(конц.)→реакции нет
Al,Fe,Cr+H2SO4(конц.)холодная→пассивация
Al, Fe, Cr +H2SO4(конц.)t˚C→SO2
4HNO3(k) + Cu = Cu(NO3)2+ 4H2O + 2NO2↑
8HNO3(p) + 3Cu = 3Cu(NO3)2+ 4H2O + 2NO↑
Внимание!
Pt, Au+HNO3→реакции нет
Al,Fe,Cr+HNO3(конц)холодная→пассивация
Al, Fe, Cr +HNO3(конц)t˚C→NO2
Al,Fe,Cr+HNO3(разб)→NO
Рассмотрим опыт и запишем уравнения реакций: взаимодействия алюминия с соляной кислотой и меди с концентрированной азотной кислотой
2Al + 6HCl = 2AlCl3+3H2
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
4. Взаимодействие с солями
с учетом правил по положению металлов в ряду напряжения
K Ca Na Mg Al Zn Fe Ni Sn Pb H2 Cu Hg Ag Au
1. Металл в ряду должен стоять до металла соли (не распространяется на щелочные и щелочноземельные металлы);
2. Все соли, участвующие в реакции должны быть растворимы
Рассмотрим опыт запишем уравнение реакции взаимодействия цинка с нитратом свинца (II)
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|