
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Термодинамика к/р № 2
Термодинамика к/р № 2
| внутренняя энергия | U | Дж | U= 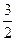 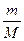 R·T U= R·T U= 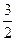 ν·R·T ∆U= ν·R·T ∆U= 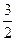 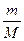 R∆T
∆U= R∆T
∆U= 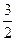 ν·R·∆T только для одноатомных инертных газов R= 8,31 ν·R·∆T только для одноатомных инертных газов R= 8,31 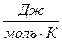
|
| работа | А′ А | Дж | А=- р∙∆V р- давление A= ─ А′ А-работа над газом А′-работа газа
А′= р∙∆V ∆V-изменение объёма
∆V =V2-V1 ∆V-изменение объёма
V1-начальный объём V2- конечный объём
для изобарного процесса А′= 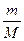 · R·∆T А′= ν·R·∆T · R·∆T А′= ν·R·∆T
|
| количество теплоты | Q | Дж | Q=cm∆t=cm(t2-t1) – при нагревании
с- удельная теплоёмкость вещества [ с]=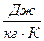 t2-конечная температура t1-начальная температура
Q=λ∙m – при плавлении
λ-удельная теплота плавления [ λ] =
t2-конечная температура t1-начальная температура
Q=λ∙m – при плавлении
λ-удельная теплота плавления [ λ] =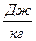 Q=r ∙m- при парообразовании
r-удельная теплота парообразования [ r]=
Q=r ∙m- при парообразовании
r-удельная теплота парообразования [ r]= 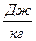 Q=q∙m- при сгорании [q]=
Q=q∙m- при сгорании [q]=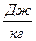 q –удельная теплота сгорания с, r, q , λ определяют по таблице в сб. задач стр. 163
q –удельная теплота сгорания с, r, q , λ определяют по таблице в сб. задач стр. 163
|
| 1 закон термодинамики | Q=∆U+A′ ∆U=Q+A изохорный процесс ∆U=Q изотермический процесс Q=A′ изобарный процесс ∆U=Q+A Q=∆U+A′ адиабатный процесс ∆U=A ∆U= - A' | ||
| коэффициент полезного действия | η | % | η= 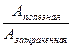 ·100%
η= ·100%
η= 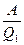 ∙100% η= ∙100% η= 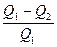 ∙100% η= 1- ∙100% η= 1-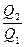 ∙100%
Q1- количество теплоты, полученное от нагревателя
Q2- количество теплоты,отданное холодильнику
η= ∙100%
Q1- количество теплоты, полученное от нагревателя
Q2- количество теплоты,отданное холодильнику
η= 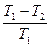 Т1- температура нагревателя
Т2- температура холодильника Т1- температура нагревателя
Т2- температура холодильника
|
| молярная масса | М | 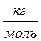
| М = Мr·10-3 Мr – относительная атомная масса (определяют по таблице Менделеева) |
| объём | V | м3 | 1л = 10-3 м3 1см2=10-4м2 1мм2=10-6м2 1см3=10-6м3 1мм3=10-9м3 |
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|