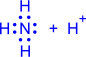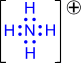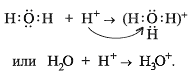- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Тема 7. Валентность и валентные возможности атомов.
ХИМИЯ
03.11.2020
Тема 7. Валентность и валентные возможности атомов.
Цели:
· образовательные: ознакомить обучающихся с понятием валентность и изучить факторы валентносной возможности атомов, степень окисления атомов в молекулах органических веществ ;
· развивающие: формировать интерес к учению; развивать познавательные интересы, творческие способности; прививать исследовательские навыки;
· воспитательные: воспитание активности; обеспечение сознательного усвоения материала.
Слово «валентность» (от лат. «valentia») возникло в середине XIX в., в период завершения химико-аналитического этапа развития химии. К тому времени было открыто более 60 элементов. Истоки понятия «валентность» содержатся в работах разных ученых. Дж.Дальтон установил, что вещества состоят из атомов, соединенных в определенных пропорциях. Э. Франкланд, собственно, и ввел понятие валентности как соединительной силы. Ф.А. Кекуле отождествлял валентность с химической связью. А.М.Бутлеров обратил внимание на то, что валентность связана с реакционной способностью атомов. Д.И.Менделеев создал периодическую систему химических элементов, в которой высшая валентность атомов совпадала с номером группы элемента в системе. Он же ввел понятие «переменная валентность».
Валентность – это количество ковалентных связей, которое образует атом в соединении с ковалентной связью.
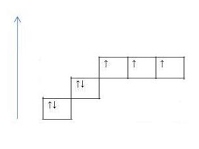
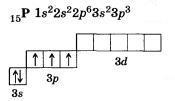
Валентность атома химического элемента не может быть выше полного числа орбиталей на внешнем уровне этого элемента. Например,
Наличие неподелённых электронных пар, способных переходить на свободные орбитали атома другого элемента (участвовать в образовании ковалентной связи по донорно-акцепторному механизму), расширяет валентные возможности атома. Например, образование третьей связи при образовании иона гидроксония, неподелённая пара электронов атома кислорода (донор) переходит на свободную орбиталь иона водорода (акцептор):
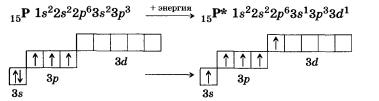
Вывод 1) числом неспаренных электронов (одноэлектронных орбиталей); 2) наличием свободных орбиталей; 3) наличием неподеленных пар электронов, способных переходить на свободные орбитали атома другого элемента (участвовать в образовании ковалентной связи по донорно-акцепторному механизму). |
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|