
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Связь между давлением и средней кинетической энергией теплового движения молекул идеального газа
Связь между давлением и средней кинетической энергией теплового движения молекул идеального газа
Большое число молекул газа и хаотичность их движения приводит к тому, что все направления их движения встречаются одинаково часто. Соударения между частицами приводят к непрерывному изменению их скоростей. Поэтому для описания движения одной частицы можно использовать законы Ньютона, а для описания движения большого числа частиц эти законы использовать нельзя. Для описания поведения большого числа частиц используют теорию вероятностей, с помощью которой находят средние значения физических величин – среднее значение скорости частицы v, среднее значение кинетической энергии частицы E.
Основное уравнение МКТ устанавливает связь между макропараметром – давлением и микропараметрами, характеризующими частицу. Давление идеального газа пропорционально произведению массы молекулы на концентрацию молекул и средний квадрат их скорости:
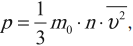
где m0 – масса частицы, n – концентрация частиц, v2¯¯¯¯¯ – среднее значение квадрата скорости.
Среднее значение квадрата скорости находится по формуле:
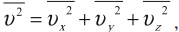
где v2x¯¯¯¯¯,v2y¯¯¯¯¯,v2z¯¯¯¯¯ – средние значения квадрата проекции скорости на оси ОХ, ОУ и ОZ соответственно.
Среднее значение квадрата проекции скорости на оси ОХ вычисляется по формуле:
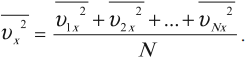
Аналогично вычисляются средние значения квадрата проекции скорости на оси ОУ и ОZ.
Так как все направления движения из-за хаотичности движения молекул равновероятны, то:
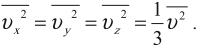
Множитель 13 появляется вследствие существования трех проекций у любого вектора скорости.
Важно!
При решении задач не путать среднее значение квадрата скорости и среднюю квадратичную скорость vск=v2¯¯¯¯¯−−√ (м/с). Единица измерения в СИ среднего значения квадрата скорости – м2/с2.
Средняя кинетическая энергия поступательного движения молекулы:
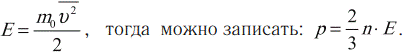
Давление идеального газа пропорционально концентрации молекул и средней кинетической энергии их поступательного движения.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|