
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Тема урока Электронная природа химической связи. Электроотрицательность.
Тема урока Электронная природа химической связи. Электроотрицательность.
Цель урока
Продолжить формирование у учащихся понятия об электронной природе химических связей. Создать понятие о единой природе химических связей.
Развить у учащихся знания о полярности связи и полярности молекулы; умения по числовым значениям электроотрицательности определять принадлежность элементов к той или иной группе.
Воспитывать самостоятельность, ответственность, активную жизненную позицию; показать единство материального мира.
Ход урока
Изучение нового материала.
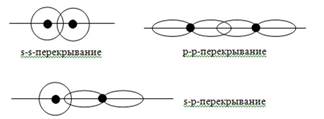 Классификация химических связей по способу перекрывания.
Классификация химических связей по способу перекрывания.
1. δ- связь (сигма) – это химическая связь, образующаяся в результате перекрывания электронных орбиталей вдоль линии связи, соединяющей ядра.
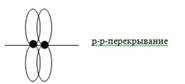
2. π-связь (пи) – это химическая связь, образующаяся в результате бокового перекрывания электронных орбиталей вне линии связи.
Химическая связь –это такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы.
- Что такое электроотрицательность?
Электроотрицательность –это способность атомов химических элементов оттягивать на себя общие электронные пары, находящиеся в совместном владении
Неполярная –ковалентная химическая связь, образующаяся между атомами с одинаковой электроотрицательностью.
Полярная – ковалентная химическая связь, образующаяся между атомами с разной электроотрицательностью.
Молекула углекислого газа неполярная, так как имеет линейное строение
Кристаллическая решётка веществ с ковалентной химической связью: атомная и молекулярная. Атомная – очень прочная (графит, алмаз), молекулярная – газы, легколетучие жидкости, твёрдые легкоплавкие вещества (хлор, вода, йод, углекислый газ – «сухой лёд»). Молекулярная кристаллическая решётка непрочная, так как внутримолекулярные связи прочные, межмолекулярное взаимодействие слабое.
Выполнить следующие задания.
1. Ответить устно на вопросы:
1.Что такое электроотрицательность?
2.Как изменяются металлические и неметаллические свойства в периоде, в группе?
3.Какие элементы обладают сильными металлическими свойствами?
4.Какие элементы обладают сильными неметаллическими свойствами?
2. Используя таблицу электроотрицательности элементов выполните задания:
1.В приведённых ниже формулах подчеркните атомы наиболее электроотрицательного химического элемента: СаСl2, К2O, N2, H2S, Al2O3.
3.Вставьте пропущенные слова:
1.Зная численные значения электроотрицательностей, можно судить о принадлежности соответствующего элемента к …… или …..
2.У металлов электроотрицательность, как правило, …….., а у неметаллов……..
3.Электроотрицательность элементов возрастает в периодах…….., а в главных подгруппах –………
4.При химических реакциях электроны ……… или ………. к атомам элементов, обладающих ……….. электроотрицательностью.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|