
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Кислотные свойства алкинов. Окисление алкинов. HCОCR + 8KMnO4 + 24HCl =5CO2 + 5RCOOH + 8MnCl2 + 8KCl + 12H2O.. С2Н2 + 5О2 = 4СО2 + 2Н2О.. Применение алкинов
Кислотные свойства алкинов
Алкины, у которых при тройной связи есть атом водорода, проявляют свойства очень слабых кислот. Они реагируют, например, с водно-аммиачными растворами солей Cu(I) и Ag(I). Атом водорода замещается на атом металла, выпадает осадок соли, которая называется ацетиленидом.
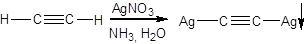
Ацетиленид меди – темно-красный, а ацетиленид серебра – желтый или белый. Это можно использовать при определении алкинов с концевой тройной связью.
Окисление алкинов
1. Обесцвечивание подкисленного раствора перманганата калия – качественная реакция на соединения с кратной связью. Рис. 1.
5HCОCR + 8KMnO4 + 24HCl =5CO2 + 5RCOOH + 8MnCl2 + 8KCl + 12H2O.
2. На воздухе алкины горят коптящим пламенем:
2С2Н2 + 5О2 = 4СО2 + 2Н2О.

Рис. 1. Обесцвечивание КМnO4
Применение алкинов
Благодаря яркому пламени в XIX веке широко распространились ацетиленовые фонари.
При горении смеси ацетилена с кислородом температура пламени достигает 2800–3000оС – можно плавить многие металлы. На этом свойстве основана ацетиленовая сварка. Рис. 2, 3.

Рис. 2. Ацетиленовая горелка

Рис. 3. Сварка и резка металлов
Кроме того, ацетилен используют в промышленном органическом синтезе для получения винилхлорида, акрилонитрила, винилацетилена – исходных веществ при производстве распространенных полимеров.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|