
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
министерство образования и науки
министерство образования и науки
донецкой народной республики
государственное образовательное учреждение
высшего профессионального образования
«ДОНБАССКАЯ АГРАРНАЯ АКАДЕМИЯ»
кафедра естественнонаучных дисциплин

Методические рекомендации
по выполнению контрольной работы по учебной дисциплине
«Физико-химические методы анализа»
направление подготовки 35.03.03 «Агрохимия и агропочвоведение»
заочной формы обучения
Макеевка, 2020 г.
министерство образования и науки
донецкой народной республики
государственное образовательное учреждение
высшего профессионального образования
«ДОНБАССКАЯ АГРАРНАЯ АКАДЕМИЯ»
кафедра естественнонаучных дисциплин
Методические рекомендации
по выполнению контрольной работы по учебной дисциплине
«Физико-химические методы анализа»
направление подготовки 35.03.03 «Агрохимия и агропочвоведение»
заочной формы обучения
Макеевка, 2020 г.
УДК 544
Чернышева Р. И. Методические рекомендации по выполнению контрольной работы по дисциплине «Физико-химические методы анализа» для студентов направления подготовки 35.03.03 «Агрохимия и агропочвоведение» заочной формы обучения / сост. Чернышева Р. И. - Макеевка: ДОНАГРА, 2020. - 12 с.
Представлены методические рекомендации по выполнению контрольных работ.
Рецензенты:
Магунова Н.Г., старший преподаватель кафедры естественнонаучных дисциплин;
Шелихов П.В., кандидат биологических наук, доцент, заведующий кафедры естественнонаучных дисциплин.
Рассмотрено на заседании предметно-методической комиссии кафедры естественнонаучных дисциплин
Протокол №__ от “__” ___________ 20___ года
Утверждено на заседании кафедры естественнонаучных дисциплин
Протокол №__ от “__” ___________ 20___ года
Рекомендовано к использованию в учебном процессе Решением Учебно-методического совета ДОНАГРА
Протокол №__ от “__” ___________ 20___ года
© ДОНАГРА, 2020
СОДЕРЖАНИЕ
| ВВЕДЕНИЕ | |
| ОБЩИЕ МЕТОДИЧЕСКИЕ УКАЗАНИЯ | |
| ПРОГРАММА ДИСЦИПЛИНЫ «ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА» | |
| 1. ПОТЕНЦИОМЕТРИЧЕСКИЙ МЕТОД АНАЛИЗА | |
| 2. КОНДУКТОМЕТРИЧЕСКИЙ МЕТОД АНАЛИЗА | |
| 3. ФОТОМЕТРИЧЕСКИЙ МЕТОД АНАЛИЗА | |
| 4. РЕФРАКТОМЕТРИЧЕСКИЙ МЕТОД АНАЛИЗА | |
| ВАРИАНТЫ ЗАДАНИЙ | |
| СПИСОК ЛИТЕРАТУРЫ |
ВВЕДЕНИЕ
В настоящее время вопросам теории и практики физико-химических и физических методов анализа уделяется большое внимание. Это обусловлено широким внедрением инструментальных методов в практику научных и производственных лабораторий, а также необходимостью повышения экспрессности анализа и решения задачи автоматизации при проведении серийных анализов. Изучая дисциплину «Физико-химические методы анализа», вы познакомитесь с теоретическими основами и практическим применением наиболее важных методов анализа, получите представление об особенностях, возможностях и ограничениях каждого метода, его аппаратурном оформлении и применении для контроля хода технологических процессов, качества сырья и готовой продукции.
ОБЩИЕ МЕТОДИЧЕСКИЕ УКАЗАНИЯ
При изучении дисциплины «Физико-химические методы анализа» прежде всего Вам надо ознакомиться с теоретическими основами различных методов по рекомендуемой учебной литературе. Теоретическая часть раздела курса состоит из ряда важнейших тем, изучение которых должно предшествовать выполнению контрольного задания и лабораторного практикума.
Решение задач должно включать расчетные формулы в общем виде и числовые значения постоянных величин. Следует приводить весь ход решения задач и все вычисления. При этом надо давать краткое объяснение при выполнении вспомогательных расчетов. Графики, которые используются для нахождения концентрации веществ, необходимо строить на масштабно-координатной бумаге –миллиметровке.
Все аналитические методы основаны на получении и измерении аналитического сигнала, т.е. любого свойства вещества, которое можно использовать для установления качественного и количественного состава объекта. Зависимость аналитического сигнала (I) от концентрации вещества (С) называется уравнением связи. Вид этой зависимости может быть линейным, логарифмическим и т. п. Удобнее всего использовать линейную зависимость вида I=kС или I=kС+b, где k и b – константы. График зависимости I=f(С) называется градуировочным (калибровочным) графиком.
Количественный анализ проводится с использованием следующих инструментальных методов.
Метод градуировочного графика – графический метод нахождения неизвестной концентрации. При проведении анализа с использованием этого метода готовят серию стандартных растворов (растворов с известной концентрацией), измеряют величины аналитических сигналов и строят градуировочный график. Затем в тех же условиях измеряют величину аналитического сигнала пробы и по графику определяют неизвестную концентрацию (Сх) вещества в растворе (рис. 1).
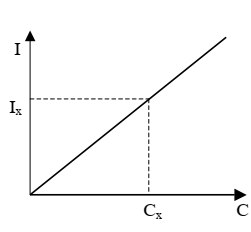
Рисунок 1 - Градуировочный график
Метод одного стандарта (метод сравнения) является расчетным. При проведении анализа с использованием этого метода в одинаковых условиях готовят один стандартный раствор с концентрацией определяемого вещества Сст и анализируемый раствор с концентрацией определяемого вещества Сх. Затем измеряют величины аналитических сигналов растворов (Iст и Iх) и рассчитывают Сх по формуле
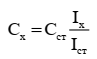
Метод двух стандартов (ограничивающих растворов) также является расчетным. При проведении анализа с использованием этого метода в одинаковых условиях готовят серию стандартных растворов и анализируемый раствор с концентрацией определяемого вещества Сх. Затем измеряют величины аналитических сигналов всех растворов и выбирают 2 эталона («ограничивающие растворы») так, чтобы С1<Cx<C2 и I1<Ix<I2. После этого рассчитывают Сх по формуле
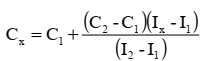
Метод добавок заключается в том, что сначала измеряют аналитический сигнал пробы Ix, затем вводят в пробу добавку определяемого вещества с известной концентрацией Сст и измеряют аналитический сигнал пробы с добавкой Ix+ст. При этом можно сделать одну добавку или несколько.
Метод одной добавки является расчетным. Сх находят по формуле

где Сст.o – первоначальная концентрация стандартного раствора; Vст. – объем стандартного раствора, добавленный к пробе; Vх – объем анализируемого раствора.
Метод двух добавок является графическим. После проведения измерений строят график в координатах «измеряемое свойство» и «концентрация добавки» и по нему находят Сх, которая соответствует отрезку, отсекаемому прямой по оси абсцисс. На рис. 2 приведен пример для двух добавок с концентрациями С1 и С2.
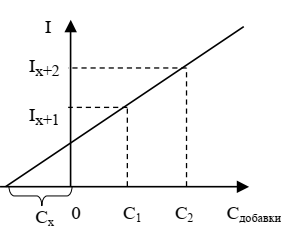
Рисунок 2 – К методу двух добавок
Косвенные методы (методы инструментального титрования)основаны на измерении аналитического сигнала в ходе титрования. Кривую титрования строят в координатах «измеряемое свойство» и «объем титранта». По кривой определяют объем титранта в точке эквивалентности. В этот момент титрования на кривой наблюдается излом или перегиб (рис. 3).
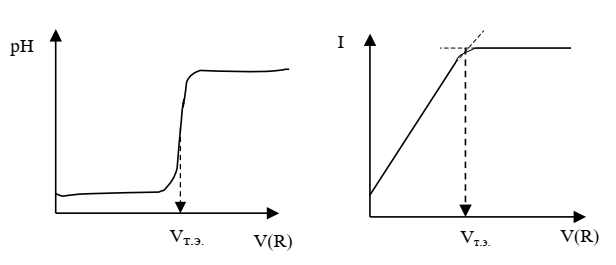
Рисунок 3 – К косвенному методу
Затем проводят расчет по закону эквивалентов. При построении кривых титрования следует сначала соединить точки плавной линией, а затем провести касательные с целью нахождения излома или перегиба. При решении задач, в условии которых описан этот прием нахождения концентрации, необходимо записать уравнение химической реакции, протекающей при титровании, и определить фактор эквивалентности определяемого вещества.
Контрольные задания составлены с учетом наиболее распространённых методов в практике агрохимических исследований. Номер варианта определяется по двум последним цифрам зачетной книжки.
ПРОГРАММА ДИСЦИПЛИНЫ
«ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА»
| Наименование темы | Содержание темы в дидактических единицах |
| Раздел 1. Введение в теоретические основы курса ФХМА | |
| Тема 1.1 Роль инструментальных методов исследований в агрономии . | 1. Объективная необходимость ФХМА в агрономии. 2. Общетеоретические вопросы физико-химических явлений и процессов в анализе. 3. Общая характеристика инструментального анализа (чувствительность, точность, достоинства, недостатки) 4. Обработка результатов анализа. |
| Раздел 2. Классификация ФХМА | |
| Тема 2.1 Аналитический сигнал | 1. Понятие и виды аналитического сигнала. 2. Классификация методов по принципу регистрации аналитического сигнала. 3.Прямые и косвенные способы измерения сигнала. 4. Абсолютные (безэталонные) и относительные методы измерений. 5. Эталон-стандарт. 6. Градуировочные графики. |
| Тема 2.2 Гравиметрический анализ | 1. Условия осаждения осадков разного типа. 2.Приминение органических осадителей. 3.Расчеты в гравиметрическом методе. 4.Стандартные и эталонные растворы |
| Тема 2.3 Электрохимические методы анализа. | 1.Классификация электрохимических методов. 2. Электрохимические ячейки. 3.Кондуктометрический анализ. Техническое оборудование и способ измерения электрической проводимости . 4.Теоретические основы потенциометрического метода. |
| Тема 2.4. Спектроскопические методы анализа | 1. Классификация методов. 2. Устройство электрофотоколориметров. Светофильтры. 3.Методики определения в почве хлорофилла и углерода. |
| Тема 2.5. Хроматографические методы анализа | 1. Сущность и классификация методов. 2. Теоретические основы процессов разделения и концентрирования веществ. |
1. ПОТЕНЦИОМЕТРИЧЕСКИЙ МЕТОД АНАЛИЗА
1. На чем основан потенциометрический метод анализа? Каковы достоинства и недостатки метода?
2. Какие графические способы нахождения конечной точки титрования используются в методе потенциометрического титрования?
3. Как определить содержание вещества методом прямой потенциометрии (расчетный и графический способы)?
4. Назначение индикаторных электродов и требования, предъявляемые к ним.
5. Назначение электродов сравнения и требования, предъявляемые к ним.
6. Приведите примеры электродов I и II рода. Укажите их применение в аналитической химии.
7. Устройство стеклянного электрода. Причина возникновения потенциала на границе раздела раствор – стеклянная мембрана.
8. Укажите области применения стеклянного электрода, его достоинства и недостатки.
9. Ионоселективные (мембранные) электроды. Причина возникновения потенциала.
10. Характеристики ионоселективных электродов.
11. Укажите приемы (методы) определения концентрации в потенциометрии.
12. Приведите примеры электродов, используемых в кислотноосновном титровании, и обоснуйте их выбор.
13. Приведите примеры электродов, используемых в осадительном титровании, и обоснуйте их выбор.
14. Приведите примеры электродов, применяемых в титровании с использованием реакций комплексообразования, и обоснуйте их выбор.
2. КОНДУКТОМЕТРИЧЕСКИЙ МЕТОД АНАЛИЗА
15. На чем основаны кондуктометрические методы анализа?
16. Как определить содержание вещества методом прямой кондуктометрии?
17. Как определить содержание вещества методом косвенной кондуктометрии (кондуктометрического титрования)?
18. Укажите отличия методов низкочастотного, высокочастотного и хронокондуктометрического титрования.
19. Дайте определение понятий «эквивалентная» и «удельная» электропроводность, «эквивалентная электропроводность при бесконечном разбавлении».
20. Укажите, от каких факторов и как зависит удельная электропроводность раствора.
21. Укажите, от каких факторов и как зависит эквивалентная (молярная) электропроводность раствора.
22. Как связаны эквивалентная и удельная электропроводности?
23. От каких факторов зависит предельная (эквивалентная) электропроводность? Как она связана с подвижностью ионов?
24. Какие условия должны выполняться для получения четки изломов на кривых титрования в реакциях нейтрализации и осаждения?
3. ФОТОМЕТРИЧЕСКИЙ МЕТОД АНАЛИЗА
25. Что называется коэффициентом пропускания и оптической плотностью? В каких пределах изменяются эти величины?
26. Каким уравнением выражается основной закон светопоглощения (закон Бугера - Ламберта - Бера)? Охарактеризовать величины, входящие в него.
27. Сформулируйте закон аддитивности светопоглощения. Как он используется в аналитической химии?
28. Действие каких факторов может привести к нарушению линейной зависимости оптической плотности от концентрации раствора?
29. Каков физический смысл молярного коэффициента поглощения ε?
30. Какие из указанных факторов влияют на ε: температура, длина волны проходящего света, концентрация раствора, природа вещества?
31. Что называется спектром поглощения и в каких координатах его можно представить?Какова природа светопоглощения в видимой области спектра?
32. Какие факторы необходимо учитывать при выборе толщины светопоглощающего слоя (кюветы)?
33. Как определяют концентрацию вещества фотометрическим методом с помощью одного стандартного раствора? Указать недостатки и достоинства этого метода.
34. Как проводится фотометрическое определение веществ методом градуировочного (калибровочного) графика?
35. Как проводится фотометрическое определение веществ методом добавок?
36. Опишите принцип работы фотоэлектроколориметра, спектрофотометра.
37. Что представляют собой нулевые растворы, или растворы сравнения, и каково их назначение?
4. РЕФРАКТОМЕТРИЧЕСКИЙ МЕТОД АНАЛИЗА
38-40. Определить нормальную концентрацию уксусной кислоты по данным табл. 1, с учетом того, что между концентрацией и показателем преломления в этом интервале существует прямолинейная зависимость (n(H2O)=1,3330).
Таблица 1
| Задача | Стандартный раствор | Анализируемый раствор | ||||
| ω, мас.% | n | ω, мас.% | n | |||
| 19,25 | 1,3468 | ? | 1,3385 | |||
| 15,20 | 1,3439 | ? | 1,3422 | |||
| 11,45 | 1,3412 | ? | 1,3461 | |||
41–43. Для определения состава водно-ацетоновых растворов были определены показатели преломления стандартных растворов (табл. 2).
Таблица 2
| Стандартные растворы | Анализируемые растворы | |||||||
| С, г/100мл | ? | ? | ? | |||||
| n | 1,334 | 1,341 | 1,349 | 1,356 | 1,361 | 1,350 | 1,346 | 1,336 |
Построить градуировочный график и определить содержание ацетона в анализируемом растворе.
44-45. Результаты измерений показателей преломления стандартных растворов сахарозы приведены в табл. 3. Построить градуировочный график и определить молярную концентрацию сахарозы в анализируемом растворе (М(С12H22O11) = 342 г/моль).
Таблица 3
| Стандартные растворы | Анализируемые растворы | ||||||
| С, г/100мл | 3,9 | 7,7 | 11,4 | 13,2 | 18,4 | ? | ? |
| n | 1,337 | 1,343 | 1,349 | 1,352 | 1,360 | 1,355 | 1,346 |
ВАРИАНТЫ ЗАДАНИЙ
| Последние цифры зачетной книжки | № варианта | Номера задач и вопросов |
| 01,11,21,31,41 | 1, 15, 25, 38, 14, 24, 37, 45 | |
| 51,61,71,81,91 | 2, 16, 26, 39, 13, 23, 36, 44 | |
| 02,12,22,32,42 | 3, 17, 27, 40, 12, 22, 35, 43 | |
| 52,62,72,82,92 | 4, 18, 28, 41, 11, 21, 34, 38 | |
| 03,13,23,33,43 | 5, 19, 29, 42, 10, 20, 33, 39 | |
| 53,63,73,83,93 | 6, 20, 30, 43, 9, 19, 32, 40 | |
| 04,14,24,34,44 | 7, 21, 31, 44, 8, 18, 30, 39 | |
| 54,64,74,84,94 | 8, 22, 32, 45, 7, 17, 31, 38 | |
| 05,15,25,35,45 | 9, 23, 33, 38, 6, 16, 29, 45 | |
| 55,65,75,85,95 | 10, 24, 34, 39, 5, 15, 28, 44 | |
| 06,16,26,36,46 | 11, 15, 35, 40, 4, 23, 27, 43 | |
| 56,66,76,86,96 | 12, 16, 36, 41, 3, 22, 26, 44 | |
| 07,17,27,37,47 | 13, 17, 37, 42, 2, 21, 25, 39 | |
| 57,67,77,87,97 | 14, 18, 25, 43, 1, 20, 37, 40 | |
| 08,18,28,38,48 | 1, 19, 26, 44, 5, 24, 36, 39 | |
| 58,68,78,88,98 | 2, 20, 27, 45, 6, 19, 35, 38 | |
| 09,19,29,39,49 | 3, 21, 28, 38, 7, 18, 34, 45 | |
| 59,69,79,89,99 | 4, 22, 29, 39, 8, 17, 33, 44 |
СПИСОК ЛИТЕРАТУРЫ
1. Громовик А.И., Йонко О.А. Современные инструментальные методы в почвоведении. Теория и практика. – Воронеж, 2010. – 60 с.
2. Кудрявцев А.Е. Общие требования к проведению лабораторных работ по физико-химическим методам анализа в агрономии, Барнаул, АлтайскийГАУ,2016. – 51 с.
3. Поддубных Л.П. Аналитическая химия и физико-химические методы анализа: лаборатор. практикум /Л.П. Поддубных; Краснояр. гос. аграр. ун-т. – Красноярск, 2014. – 131 c.
4. СоколоваС.А. Физико-химические методы анализа. - Воронеж, 2012. - 157с.
5. Ткаченко, С. В. Аналитическая химия. Химические методы анализа: учебное пособие / С.В. Ткаченко, С.А. Соколова. - Воронеж: ФГБОУ ВПО ВГАУ, 2015. – 188 с.
6. Физико химические методы анализа: Практикум /. В. Д. Валова (Копылова), Л. Т. Абесадзе. - М.: Издатель СКО торговая корпорация «Дашков и К°», 2014. 224с.
7. Цитович, И.К. Курс аналитической химии: Учебник для сельскохозяйственных вузов / И.К. Цитович. – 10-е изд., испр. и доп. – М. : Лань, 2009 . – 495 с.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|