
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Домашняя работа
1. Углерод. Аллотропия углерода
Теория:
Химический элемент
Углерод — химический элемент № 6. Он расположен в IVА группе Периодической системы.
C6+6)2e)4e
На внешнем слое атома углерода содержатся четыре валентных электрона, и до его завершения не хватает четырёх электронов. Поэтому в соединениях с металлами углероду характерна степень окисления –4, а при взаимодействии с более электроотрицательными неметаллами он проявляет положительные степени окисления: +2 или +4.
В природе углерод встречается как в виде простых веществ, так и в виде соединений. В воздухе содержится углекислый газ. В земной коре распространены карбонаты (например, CaCO3 образует мел, мрамор, известняк). Горючие ископаемые (уголь, торф, нефть, природный газ) состоят из органических соединений, главным элементом которых является углерод.
Углерод относится к жизненно важным элементам, так как входит в состав молекул всех органических веществ.
Простые вещества
Углерод образует несколько аллотропных видоизменений, из которых наиболее известны алмаз и графит.
Алмаз имеет атомную кристаллическую решётку. Каждый атом углерода в алмазе связан четырьмя прочными ковалентными связями с соседними атомами, расположенными в вершинах тетраэдра.
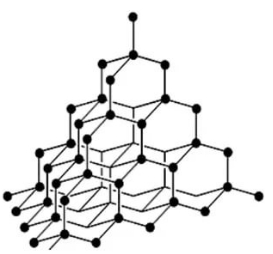
Благодаря такому строению алмаз — самое твёрдое из известных природных веществ. Все четыре валентных электрона каждого атома углерода участвуют в образовании связей, поэтому алмаз не проводит электрический ток. Это бесцветное прозрачное кристаллическое вещество, хорошо преломляющее свет.

Графит тоже имеет атомную кристаллическую решётку, но устроена она иначе. Решётка графита слоистая. Каждый атом углерода соединён прочными ковалентными связями с тремя соседними атомами. Образуются плоские слои из шестиугольников, которые между собой связаны слабо. Один валентный электрон у атома углерода остаётся свободным.
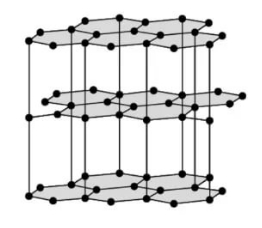
Графит представляет собой тёмно-серое вещество с металлическим блеском, жирное на ощупь. В отличие от алмаза графит непрозрачный, проводит электрический ток и оставляет серый след на бумаге. У графита очень высокая температура плавления (3700 °С).

Алмаз и графит взаимопревращаемы. При сильном нагревании без доступа воздуха алмаз чернеет и превращается в графит. Графит можно превратить в алмаз при высокой температуре и большом давлении.
Из мельчайших частиц графита состоят сажа, древесный уголь и кокс. Сажа образуется при неполном сгорании топлива. Древесный уголь получают при нагревании древесины без доступа воздуха, а кокс — переработкой каменного угля.
Древесный уголь имеет пористое строение и обладает способностью поглощать газы и растворённые вещества. Такое свойство называется адсорбцией.

Химические свойства
Аллотропные модификации углерода в химических реакциях могут проявлять и окислительные, и восстановительные свойства. Окислительные свойства углерода выражены слабее, чем у других неметаллов второго периода (азота, кислорода и фтора).
· Взаимодействие с металлами.
Углерод реагирует с металлами при высокой температуре с образованием карбидов:
4Al0+3C0=tAl+34C−43.
В этой реакции углерод выступает как окислитель.
· Взаимодействие с водородом.
Реакция происходит при сильном нагревании. Образуется метан. Углерод — окислитель.
C0+2H02=tC−4H+14.
· Взаимодействие с кислородом.
Углерод горит в кислороде с образованием углекислого газа и проявляет в этой реакции восстановительные свойства:
C0+O02=tC+4O−22.
· Взаимодействие с оксидами металлов.
Углерод способен восстанавливать металлы из их оксидов:
2Cu+2O+C0=t2Cu0+C+4O2.
Применение простых веществ
Алмазприменяется:
· для обработки твёрдых поверхностей;
· для резки стекла;
· для изготовления буров и свёрл;
· для изготовления ювелирных украшений.
Графит используется:
· при изготовлении карандашей;
· как твёрдая смазка в подшипниках;
· для изготовления электродов;
· в качестве замедлителя нейтронов в ядерных реакторах;
· для получения искусственных алмазов.
Сажа:
· входит в состав типографской краски, крема для обуви;
· используется как наполнитель для производства резины.
Уголь используется:
· в противогазах, промышленных и бытовых фильтрах;
· для очистки сахарного сиропа, спирта и т. д.;
· в медицине.
Кокс применяется в металлургической промышленности.
2. Оксиды углерода
Теория:
Оксид углерода(II), или угарный газ
Оксид углерода(II) CO образуется при неполном сгорании топлива. Это бесцветный газ без запаха. Он плохо растворяется в воде (2,3 см³ в 100 см³ при 20 °С). Оксид углерода(II) очень ядовит. При вдыхании его молекулы связываются с гемоглобином крови и препятствуют переносу кислорода.
Оксид углерода(II) относится к несолеобразующим оксидам. При обычных условиях он не реагирует с водой, кислотами и основаниями.
Является сильным восстановителем. Восстановительные свойства проявляет в реакциях с оксидами металлов и кислородом. Оксид углерода(II) отнимает кислород от оксидов металлов. В результате реакции образуются металл и углекислый газ:
Cu+2O+C+2O=tCu0+C+4O2.
Оксид углерода(II) горит на воздухе голубым пламенем:
2C+2O+O02=t2C+4O−22.
В реакции выделяется большое количество тепла.
Оксид углерода(IV), или углекислый газ
Оксид углерода(IV) CO2 — бесцветный газ без запаха. Он примерно в 1,5 раза тяжелее воздуха. Малорастворим в воде (при комнатной температуре в 1 объёме воды растворяется 0,88 объёма CO2). При охлаждении и повышенном давлении углекислый газ превращается в твёрдое вещество — «сухой лёд», который способен возгоняться, т. е. из твёрдого состояния переходить сразу в газообразное.

Сухой лёд
Оксид углерода(IV) — типичный кислотный оксид. Он взаимодействует с водой, основными оксидами и щелочами. В реакции с водой образуется неустойчивая угольная кислота:
CO2+H2O⇄H2CO3.
В реакциях с основными оксидами и щелочами образуются карбонаты:
CO2+CaO=CaCO3,
CO2+2NaOH=Na2CO3+H2O.
При взаимодействии щёлочи с избытком углекислого газа образуются гидрокарбонаты:
CO2+NaOH=NaHCO3.
В углекислом газе степень окисления углерода максимальная, поэтому он может проявлять окислительные свойства. Так, магний горит в атмосфере углекислого газа:
C+4O2+2Mg0=t2Mg+2O+C0.
Получение:
· в лаборатории углекислый газ получают действием кислот на карбонаты:
CaCO3+2HCl=CaCl2+H2O+CO2↑.
· В промышленности для его получения используют обжиг известняка:
CaCO3=tCaO+CO2↑⏐⏐.
В природе углекислый газ образуется при дыхании и сгорании топлива, при гниении и тлении органических веществ, а поглощается растениями в процессе фотосинтеза.
Применение
Угарный газ используется:
· в качестве топлива;
· как восстановитель в производстве чугуна;
· для получения метанола.
Углекислый газ применяется:
· в производстве газированных напитков;
· для тушения пожаров;
· для охлаждения пищевых продуктов («сухой лёд»).
· 3. Угольная кислота и её соли
· Теория:
· Угольная кислота
· Угольная кислотаH2CO3 — раствор углекислого газа в воде. Это слабая двухосновная кислота. Она образуется при растворении в воде оксида углерода(IV) и в свободном виде из раствора не выделяется. При попытке выделения кислота легко разлагается на углекислый газ и воду:
·
· H2CO3⇄CO2↑+H2O.
·
· Угольная кислота диссоциирует ступенчато. На первой ступени образуется гидрокарбонат-ион и ион водорода:
·
· H2CO3⇄HCO−3+H+.
·
· Гидрокарбонат-ион частично распадается на карбонат-ион и ещё один ион водорода:
·
· HCO−3⇄CO2−3+H+.
·
· Диссоциация протекает слабо, ионов водорода в растворе содержится немного. Поэтому раствор углекислого газа (угольная кислота) имеет слегка кисловатый вкус и меняет окраску лакмуса на розовую (не красную).
· Соли угольной кислоты
· Как двухосновная угольная кислота образует два ряда солей: средние — карбонаты (K2CO3, CaCO3) и кислые — гидрокарбонаты(NaHCO3, Ca(HCO3)2).
·
· Из карбонатов растворяются в воде соли натрия, калия и аммония. Гидрокарбонаты растворяются лучше.
·
· Обрати внимание!
· Все соли угольной кислоты реагируют с более сильными кислотами.
· В результате выделяется углекислый газ, что позволяет использовать эту реакцию как качественную на карбонаты и гидрокарбонаты:
·
· CaCO3+2HCl=CaCl2+H2O+CO2↑,
·
· NaHCO3+HNO3=NaNO3+H2O+CO2↑.
·
· 
· Реакция карбоната с кислотой
·
· Обрати внимание!
· Карбонаты и гидрокарбонаты взаимопревращаемы.
· Карбонаты превращаются в гидрокарбонаты при пропускании через их раствор или взвесь углекислого газа:
·
· CaCO3+H2O+CO2=Ca(HCO3)2.
·
· Обратное превращение происходит при нагревании:
·
· Ca(HCO3)2=tCaCO3⏐↓⏐+H2O+CO2↑⏐⏐.
·
· С присутствием в воде гидрокарбонатов кальция и магния связана временная жёсткость воды. Временная — потому что при нагревании растворимые кислые соли разлагаются, и ионы металлов связываются в нерастворимые карбонаты.
· Применение солей угольной кислоты
· Na2CO3 — карбонат натрия, или сода. Применяется в производстве стекла, мыла, бумаги.
·
· NaHCO3 — гидрокарбонат натрия, или питьевая сода. Используется в быту и пищевой промышленности как разрыхлитель теста. Находит применение в медицине.
·
· 
·
· K2CO3 — карбонат калия, или поташ. Применяется в производстве жидкого мыла, стекла, в качестве удобрения.
·
· CaCO3 — карбонат кальция. В природе встречается в виде мела, мрамора, известняка. Применяются как строительные и отделочные материалы, а также в производстве негашёной извести, цемента, стекла.
·
· 
·
Домашняя работа
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|