
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Задание по физике для 1 курсов
Задание по физике для 1 курсов
Тема: Идеальный газ. Температура в МКТ
1.Актуализация знаний учащихся
-В каких агрегатных состояниях могут быть веществ?
- Назовите газы, которые вы знаете
-Какие общие свойства есть у всех газов?
2.Работа над новым материалом
В реальных газах: кислороде, азоте, метане, гелии и т.д. размеры и массы молекул разные, совершенно резное строение и скорости молекул.
Для изучения общих свойств газов используется модель: ИДЕАЛЬНЫЙ ГАЗ
Идеальный газ - это физическая модель газа, взаимодействие между молекулами которого пренебрежительно мало. Понятие "идеальный газ" вводится для математического описания поведения газов. Реальные разреженные газы ведут себя как идеальный газ! Свойства идеального газа:
- взаимодействие между молекулами пренебрежительно мало;
- расстояние между молекулами много больше размеров молекул;
- молекулы - это упругие шары;
- отталкивание молекул возможно только при соударении;
- движение молекул - по законам Ньютона;
- давление газа на стенки сосуда - за счет ударов молекул газа.
Скорость молекул газа
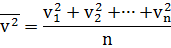 В теории газов скорость молекул принято определять через среднее значение квадрата скорости молекул. Хотя скорости различных молекул сильно отличаются друг от друга, но среднее значение квадрата скорости молекул есть величина постоянная. Формула для расчета среднего значения квадрата скорости молекул газа:
В теории газов скорость молекул принято определять через среднее значение квадрата скорости молекул. Хотя скорости различных молекул сильно отличаются друг от друга, но среднее значение квадрата скорости молекул есть величина постоянная. Формула для расчета среднего значения квадрата скорости молекул газа:
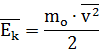 где n - число молекул в газе v - модули скоростей отдельных молекул в газе. В теории газов часто используется понятие кинетической энергии молекул. Используя среднее значение квадрата скорости молекул, получаем формулу для определения средней кинетической энергии молекул:
где n - число молекул в газе v - модули скоростей отдельных молекул в газе. В теории газов часто используется понятие кинетической энергии молекул. Используя среднее значение квадрата скорости молекул, получаем формулу для определения средней кинетической энергии молекул:
Состояние газа однозначно задается тремя макроскопическими параметрами:
давлением, объемом и температурой.
Мы знаем, что горячий воздух поднимается вверх. С увеличением температуры он становится легче – уменьшается плотность, увеличивается расстояние между молекулами. То есть происходит расширение – увеличение объема. Можно сделать вывод, что объем и температура газа связаны. Если сдавить воздушный шарик, то внутри него увеличится давление. То есть объем газа также связан с давлением. Получается, что давление, объем и температура газа связаны между собой. Попробуем понять, как именно.
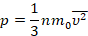 Мы работаем с моделью идеального газа, которая описывает реальный газ достаточно точно для решения многих задач. Мы уже получили для идеального газа основное уравнение МКТ, с помощью которого связали давление с микропараметрами – массой и средней скоростью одной молекулы:
Мы работаем с моделью идеального газа, которая описывает реальный газ достаточно точно для решения многих задач. Мы уже получили для идеального газа основное уравнение МКТ, с помощью которого связали давление с микропараметрами – массой и средней скоростью одной молекулы:
Мы приняли, что газ состоит из хаотично движущихся молекул – и вычислили, как они действуют на стенку, какое давление создают, когда с ней сталкиваются. Но мы не измеряем скорости и массы отдельных молекул. На макроуровне мы умеем измерять температуру, которую мы связали со средней кинетической энергией молекул, а значит, и с микропараметрами: массой и средней скоростью одной молекулы: 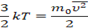
Подставив кинетическую энергию из одного уравнения в другое, получили: 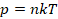
Температура связана с понятием теплового равновесия. При контакте тела обмениваются энергией, которая передается и получает название количества теплоты.
Тепловым равновесием называют состояние системы тел, которые находятся в тепловом контакте с теплопередачей и с постоянными макроскопическими параметрами.
Температура измеряется с помощью термометра.
В 1597 году Галилей создал термоскоп, в собственных сочинениях учёного нет описания этого прибора, но его ученики засвидетельствовали этот факт. Аппарат представлял собой устройство для поднятия воды при помощи нагревания.
Изобретение термометра, данные которого не зависели бы от перепадов атмосферного давления, произошли благодаря экспериментам физика Э. Торричелли, ученика Галилея.
Во всех приборах, изобретённых в XVIII веке, измерение температуры было относительно расширению столбика воды, спирта или ртути и произвольности выбора начала отсчёта, т.е. нулевой температуры. Наполняющие их вещества замерзали или кипели и этими термометрами нельзя было измерять очень низкие или очень высокие температуры. Шкала, предложенная шведским учёным Андерсом Цельсием в 1742 г., точно устанавливала положение двух точек: 0 и 100 градусов. Температура плавления льда равняется 0 градусов Цельсия, а точка кипения воды – 100 градусов. Одно маленькое деление из шкалы равняется 1 градусу. По шкале Цельсия температура обозначается буквой t, измеряется в градусах Цельсия (ºС).
На территории Англии и США используется шкала Фаренгейта. Такая шкала была предложена немецким учёным Даниелем Габриелем Фаренгейтом в 1724 г.: 0 °F — температура смеси снега с нашатырём или поваренною солью, 96 °F —температура здорового человеческого тела, во рту или под мышкой.
Рене Антуан де Реомюр не одобрял применения ртути в термометрах вследствие малого коэффициента расширения ртути. В 1730 году изобрёл водно-спиртовой термометр и предложил шкалу от 0 до 80°. Шкала Реомюра очень долго использовалась на родине учёного во Франции вплоть до настоящего времени.
Различные жидкости при нагревании расширяются не одинаково. Поэтому расстояния на шкале между нулевой отметкой 0 °C и 100 °C будут разными.
Тело, которое приближенно обладает нужными качествами-это идеальный газ. Было замечено, что в отличие от жидкостей все разряжённые газы – водород, гелий, кислород – расширяются при нагревании одинаково и одинаково меняют своё давление при изменении температуры. Это свойство газов позволяет избавиться в термометрах от одного существенного недостатка шкалы Цельсия – произвольности выбора начала отсчёта, то есть нулевой температуры.
При тепловом равновесии, если давление и объём газа массой m постоянны, то средняя кинетическая энергия молекул газа должна иметь строго определённое значение, как и температура. Температура является мерой для кинетической энергии молекул, которая не зависит от ее величины.
Наиболее распространённые в быту термометры – ртутные, спиртовые и т.д. – не отвечают физическим стандартам измерения температур.
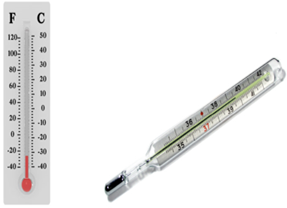
Причины этому две:
- Различные термометры используют различные вещества в качестве индикатора, поэтому на одно и то же изменение температуры в зависимости от свойств конкретного вещества термометры реагируют по-разному;
- Произвольность выбора начала отсчёта шкалы температур.
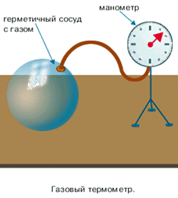 Поэтому для любых точных замеров температур такие термометры не годятся. И начиная с восемнадцатого века, используются более точные газовые термометры
Поэтому для любых точных замеров температур такие термометры не годятся. И начиная с восемнадцатого века, используются более точные газовые термометры
Для работы с физическими величинами необходима другая, абсолютная шкала. Эту шкалу ввёл в 1848 г английский физик Уильям Томпсон (лорд Кельвин). Зная, что при росте температур тепловая скорость движения молекул и атомов тоже растёт, нетрудно установить, что при уменьшении температур скорость будет падать и при определённой температуре рано или поздно станет нулём, как и давление (исходя и основного уравнения МКТ). Эту температуру и выбрали за начало отсчёта. Совершенно очевидно, что температура не может достигнуть значения меньше этого значения, поэтому оно получило название «абсолютный ноль температур». Для удобства же 1 градус по шкале Кельвина был приведён в соответствии с 1 градусом по шкале Цельсия.
Итак, получаем следующее: Обозначение температуры – 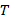 ;
;
Единица измерения – К, «кельвин»
Перевод к шкале Кельвина: 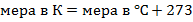
Следовательно, абсолютный ноль температур – это
температура 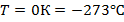
Задание:
Подготовить конспект нового материала урока;
Просмотреть видеоролики:
1. Идеальный газ в молекулярно-кинетической теории | Физика 10 класс | Инфоурок
2. Температура и тепловое равновесие. Определение температуры | Физика 10 класс
3. Абсолютная температура | Физика 10 класс #31 | Инфоурок
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|