
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Опорный конспект
Опорный конспект
а) Нахождение молекулярной формулы органического соединения по общей формуле класса органических веществ:
- Пример задачи: «Определите молекулярную формулу алкана, обнаруженного в кожуре яблок, молекулярная масса которого равна 436»,
- Повторим алгоритм:
АЛГОРИТМ №1.
1. Вспоминаем общую формулу названного класса органических соединений.
2.Записываем сумму масс атомов химических элементов в молекуле, выразив неизвестные индексы через «n». Приравниваем полученное выражение к известной молекулярной или молярной массе вещества.
3. Рассчитываем значение «n» и записываем общую формулу органического соединения.
4. При необходимости даем название веществу, записываем его структурную формулу и формулы его изомеров.
Решаем задачу:
1.СnH2n+2
2. 12n+2n+2=436
3. n=31 => C31H64
б) Нахождение молекулярной формулы органического соединения по массовым долям химических элементов в веществе, а также по плотности веществ и относительной плотности газов:
- Пример задачи: «Углеводород, образующийся при термическом крекинге октана содержит 85, 7% углерода. Относительная плотность его по водороду равна 28. Определите молекулярную формулу вещества»
- Повторим алгоритм:
АЛГОРИТМ №2.
1. Вычисляем молярную массу вещества.
М(в) = D(x) * М(х) (1)
2. Вычисляем количество атомов элемента:
а) если w дана в процентах:
n(Э) = 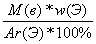 (2)
(2)
б) если w дана в долях:
n(Э) = 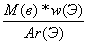 (3)
(3)
3. Вычисляем молярную массу полученного вещества.
4. Если молярная масса полученного вещества равна молярной массе вещества (1), тогда задача решена правильно; если молярная масса полученного вещества отличается от молярной массы вещества (1), вычисляем разность и определяем количество атомов кислорода, если вещество кислородосодержащие, или азота, если вещество азотосодержащее.
Решаем задачу.
1. M=28 * 2 = 56 г/моль
2. x=56 * 85,7 : 1200 = 4
y=56 * (100-85,7) : 100 = 8
3. M (C4H8) = 56 г/моль => задача решена правильно.
в) Нахождение молекулярной формулы органического соединения по продуктам его сгорания:

Прибор для органического анализа Дюма-Либиха.
-Суть анализа проста: надо взять известную массу органического соединения, сжечь его и определить, сколько получилось продуктов сгорания. Затем перейти к решению задачи на вывод формулы органического соединения. Прибор для органического анализа состоит из устройства для сжигания в воздухе обогащенном кислородом и системы ловушек для поглощения основных продуктов сгорания. Современные приборы действуют на том же самом принципе, хотя их чувствительность и скорость несравнимы с приборами Дюма и Либиха. Приборы, выпускаемые сейчас, позволяют взять для анализа буквально десятые доли миллиграмма. При этом анализ выполняется очень быстро.
- Пример задачи: «Определите молекулярную формулу продукта реакции Зелинского – Казанского при сжигании 3,9 г которого образуется 13,2 г оксида углерода (IV) и 2,7 г воды. Плотность вещества по воздуху равна 2,69.»
- Повторим алгоритм:
АЛГОРИТМ №3.
1. Вычисляем молярную массу вещества.
М(в) = D(x) * М(х) (1)
2. Вычисляем количество атомов С:
а) если СО2 дано по массе:
n(C) = 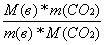 (2)
(2)
б) если СО2 дано в объеме:
n(C) = 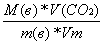 (3)
(3)
3. Вычисляем количество атомов Н:
Так как в молекуле Н2О 2 моля Н, формулу умножаем на 2 (это применимо и к N)
n(Н) = 2 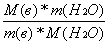 (4)
(4)
4. Вычисляем молярную массу полученного вещества.
5. Если молярная масса полученного вещества равна молярной массе вещества (1), тогда задача решена правильно; если молярная масса полученного вещества отличается от молярной массы вещества (1), вычисляем разность и определяем количество атомов кислорода, если вещество кислородосодержащие, или азота, если вещество азотосодержащее.
Решение:
1.M (CxHyOz) = 2,69 * 29 = 78 г/моль
2. x = (78*13,2) : (3,9* 44) = 1029,6 : 171,6 = 6
3. y = 2 * (78 * 2,7) : (3,9 * 18) = 2 * 210,6 : 70,2 = 6
4. M (C6H6) = 12 * 6 + 6 = 78 г/моль => вещество не содержит кислород, задача решена правильно.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|