
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Общая и неорганическая химия. Пояснительная записка
Министерство образования и науки Донецкой Народной Республики
ГПОУ Макеевский промышленно-экономический колледж
Общая и неорганическая химия
Методические указания и контрольные задания для студентов заочного отделения
специальности 18.02.10 «Коксохимическое производство»
среднего профессионального образования базовой подготовки
Макеевка, 2019
Методические указания и контрольные задания для студентов заочного отделения
разработаны на основе государственного образовательного стандарта среднего профессионального образования по профессии 18.02.10 Коксохимическое производство утвержденного приказом Министерства образования и науки ДНР от 17.07.2015 г. № 325
Организация-разработчик: ГПОУ Макеевский промышленно-экономический колледж
Разработчик Некращук Т.Н. преподаватель-методист высшей квалификационной категории
Пояснительная записка
Цель изучения дисциплины – ознакомить студентов с процессами превращения веществ, сопровождающимися изменением химических и физических свойств.
В современной жизни, особенно в производственной деятельности человека, химия имеет исключительно важное значение. Химические реакции широко используются во многих производственных процессах. Это реакции, сопровождающие получение электроэнергии, топлива, металлов, различных материалов. Так, в настоящее время получение электрической энергии связано в основном с преобразованием химической энергии природного топлива. В основе этого процесса лежат реакции горения, взаимодействия различных компонентов топлива и пр. Знания об энергетике химических реакций, факторах, влияющих на скорость протекания процессов, способах смещения равновесия в системах, позволят будущему инженеру-энергетику решать важные производственные задачи.
Основной формой занятий для студентов-заочников является самостоятельная работа над учебным материалом. Это предусматривает изучение материала по учебникам и методическим пособиям, выполнение контрольных заданий и лабораторного практикума, индивидуальные консультации, посещение лекций, сдачу экзамена.
Контрольная работа своими заданиями охватывает основные разделы курса. При ее выполнении следует проработать теоретическую часть курса и разобрать решение задач, приведенных в методическом пособии по соответствующим темам и разделам. Ответы на задания должны быть по своему варианту, номер которого соответствует номеру студента в списке группы. Сначала следует ознакомиться с требованиями программы, затем приступить к изучению материала по учебнику. При этом необходимо выделять основные положения, выписывать формулы законов, уравнения реакций, определения. Закрепление материала достигается при ответах на вопросы в конце каждой главы в учебниках. Подтверждением полного усвоения изученного материала являются ответы на вопросы, предлагаемые в контрольной работе. Эти ответы должны быть краткими, но четкими и обоснованными.
Оформление контрольной работы:
1. Выполняют работу в тонкой тетради, оставляя поля для замечания преподавателя.
2. Сначала пишут вопрос, затем ответ на него.
3. Порядок вопросов не меняют.
4. При решении задачи обязательно записывают весь ход решения со всеми математическими преобразованиями.
5. В конце работы указывается список использованной литературы, ставится дата и подпись студента.
Раздел 1. ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ ХИМИИ
1. Введение
Химия как предмет естествознания. Предмет химии и ее связь с другими науками. Значение химии в формировании научного мировоззрения в изучении природы и развитии техники. Химия и охрана окружающей среды.
2. Строение атома и систематика химических элементов
Квантово - механическая модель атома. Квантовые числа. Атомные орбитали. Принцип Паули. Правила и порядок заполнения атомных орбиталей. Строение многоэлектронных атомов. Периодическая система элементов Д.И. Менделеева. Изменение свойств химических элементов и их соединений. Окислительно-восстановительные свойства элементов. Значение периодического закона Д.И. Менделеева. [1, 4–19; 2, 17-31].
3. Химическая связь. Типы взаимодействия молекул. Комплексные соединения
Основные типы и характеристики химической связи. Ковалентная и ионная связь. Метод валентных связей, понятие о методе молекулярных орбиталей. Строение и свойства простейших молекул.
Основные виды взаимодействия молекул. Силы межмолекулярного взаимодействия. Водородная связь. Донорно-акцепторное взаимодействие молекул. Комплексные соединения. Комплексы, комплексообразователи, лиганды, заряд и координационное число комплексообразователя. Типы комплексных соединений. Понятие о теориях комплексных соединений [1, 19-20; 3, 98-113]
4. Химия вещества в конденсированном состоянии
Агрегатное состояние вещества. Химическое строение твердого тела. Аморфное и кристаллическое состояние вещества. Кристаллы. Кристаллические решетки. Химическая связь в твердых телах. Металлическая связь и металлы, химическая связь в полупроводниках и диэлектриках. Реальные кристаллы [3, 114,185-188; 2, 82-110].
Раздел 2. ОБЩИЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКИХ ПРОЦЕССОВ
2.1. Энергетика химических процессов. Химическое равновесие
Энергетические эффекты химических реакций. Внутренняя энергия и энтальпия. Термохимия. Законы Гесса. Энтальпия образования химических соединений. Энтропия и ее изменения при химических процессах. Энергия Гиббса и энергия Гельмгольца и ее изменение при химических процессах. Условия самопроизвольного протекания реакций. Константа равновесия и ее связь с термодинамическими функциями, принцип Ле - Шателье [1, 37-42; 2, 121-129; 3, 121-127].
2.2. Равновесие в гетерогенных системах
Химическое равновесие в гетерогенных системах. Фазовое равновесие и правило фаз. Физико-химический анализ двухкомпонентных систем. Распределение третьего компонента между двумя несмешивающимися жидкостями. Экстракция. Сорбция. Поверхностные вещества. Адсорбция. Адсорбционное равновесие.
Гетерогенные дисперсные системы. Коллоидные системы и их получе-ние. Строение коллоидных частиц. Агрегативная и кинетическая устойчи-вость систем. Коагуляция. Эмульсии. Суспензии. [1, 74-87; 2, 231-242].
2.3. Химическая кинетика
Скорость химической реакции и ее зависимость от концентрации и температуры. Константа скорости реакции. Гомогенный катализ. Цепные реакции. Физические методы ускорения химических реакций. Скорость гетерогенных химических реакций. Гетерогенный катализ.[1, 43–54; 2, 167–177].
Раздел 3. Растворы
3.1. Растворы
Типы растворов, способы выражения концентрации растворов. Законы идеальных растворов. Растворы не электролитов и электролитов. Водные растворы электролитов. Сильные и слабые электролиты. Свойства растворов электролитов.
Активность. Электролитическая диссоциация воды. Водородный показатель среды. Ионные реакции в растворах. Произведение растворимости. Буферные растворы.
Гидролиз солей. Диссоциация комплексных соединений. Теория кислот и оснований.[1, 55-62; 2, 204-220].
Раздел 4. Электрохимические процессы
4.1. Электрохимические процессы
Окислительно-восстановительные процессы: определение, термодина-мика, составление уравнений реакций. Определение, классификация электро-химических процессов. Термодинамика электродных процессов. Понятие об электродных потенциалах. Гальванические элементы. ЭДС и ее измерение. Стандартный водородный электрод и водородная шкала потенциалов. Уравнение Нерста. Потенциалы металлических, газовых и окислительно-восстановительных электродов. Кинетика электродных процессов. Электро-химическая и концентрационная поляризация. Электролиз. Последователь-ность электродных процессов. Выход потоку. Законы Фарадея. Электролиз нерастворимыми и растворимыми анодами. Практическое применение электролиза. [1, 88-100; 2, 259-270].
4.2. Коррозия и защита металлов и сплавов
Основные виды коррозии. Химическая коррозия. Электрохимическая коррозия. Коррозия под действием блуждающих токов. Метод защиты от коррозии: легирование, электрохимическая защита, защитные покрытия. Изменение свойств коррозионной среды. Ингибиторы коррозии [1, 130-136, 159- 169; 2, 311-320].
1. Написать электронные формулы атомов элементов с порядковыми номерами 9 и 28. Показать распределение электронов этих атомов по квантовым ячейкам. К какому электронному семейству относятся каждый из них. Укажите значение квантовых чисел для последнего энергетического уровня.2. Дать полную характеристику элементe № 13. Укажите значение квантовых чисел для последнего энергетического уровня.3. Дать полную характеристику элементу № 15. Укажите значение квантовых чисел для последнего энергетического уровня.4. Дать полную характеристику элементу № 32. Укажите значение квантовых чисел для последнего энергетического уровня.5. Дать полную характеристику элементу № 34. Укажите значение квантовых чисел для последнего энергетического уровня.6. Дать полную характеристику элементу № 18. Укажите значение квантовых чисел для последнего энергетического уровня.7. Дать полную характеристику элементу № 33. Укажите значение квантовых чисел для последнего энергетического уровня.8. Дать полную характеристику элементу № 35. Укажите значение квантовых чисел для последнего энергетического уровня.9. Дать полную характеристику элементу № 17. Укажите значение квантовых чисел для последнего энергетического уровня.10. Дать полную характеристику элементу № 16. Укажите значение квантовых чисел для последнего энергетического уровня.11. Какова современная формулировка периодического закона? Объясните, почему в периодической системе аргон находится перед калием, хотя аргон имеет большую атомную массу?12. Как изменяются радиусы атомов в пределах: a) одного периода; b) группы? Почему? Сопоставьте изменения радиусов с изменением свойств элементов II периода и IV группы главной подгруппы.13. Бор имеет два изотопа, атомная масса которых 10 и 11. Относительная атомная масса бора равна 10,82. Вычислите относительное содержание каждого из изотопов в природном бору (в процентах).14. Чем отличаются по своему составу ядра следующих изотопов: 6Li и 7Li; 235U и 239U, 12С и 13С; 41К и 42К? Что у них общего?15. Среди приведенных ниже электронных конфигураций укажите невозможные: 1р3; 3р6; 2d5; 5d2; 3р7; 2p4. Объясните свой выбор.16. Химический элемент состоит из двух изотопов, находящихся в соотношении 9:1. Ядро первого изотопа содержит 10 протонов и 10 нейтронов, второго - 10 протонов и 12 нейтронов. Вычислите относительную атомную массу элемента.17. При взаимодействии 9,2 г одновалентного металла с хлором получено 23,4 г хлорида. Определите металл. Дать полную характеристику этого элемента.18. При взаимодействии 4,6 г одновалентного металла с водой выделился 0,1 моль водорода. Определите металл. Дать полную характеристику этого элемента.19. При взаимодействии 12,4 г оксида одновалентного металла с водой образовалось 16 г его гидроксида. Определите металл. Дать полную характеристику этого элемента.20. Определите металл, если 9 г гидроксида металла (II) при разложении образуют 7,2 г оксиды металла (II). Дать полную характеристику этого элемента.21. При взаимодействии 4 г двухвалентного металла с бромом получили 20 г бромида. Определите металл. Дать полную характеристику этого элемента.22. При сгорании 6,4 г элемента образовалось 12,8 г оксида состава RО2. Определите элемент. Дать полную характеристику этого элемента.23. При взаимодействии 34,25 г двухвалентного металла с водой выделилось 5,6 л водорода (при н.у.). Определите металл. Дать полную характеристику этого элемента.24. При разложении 25 г карбоната двухвалентного металла выделилось 5,6 л оксида углерода (IV) (н.у.). Определите формулу соли. Дать полную характеристику найденного металла.25. 9 г трехвалентного металла прореагировало с соляной кислотой, при этом выделилось 11,2 л водорода (н.у.). Назовите элемент. Дать полную характеристику этого элемента.26. Что показывает номер элемента в периодической таблице, номер периода, номер группы, в которых элемент содержится?27. Объясните, почему атомные массы большинства элементов, которые приведены в периодической таблице, имеют нецелочисленное значения.28. Какой критерий образования связи, что такое ионная и ковалентная связи?29. Как изменяются свойства элементов а) в периодах; б) в группах периодической таблицы? Объясните причину их изменения.30. Приведите примеры водородной связи, донорно-акцепторной связи.31. Какая масса угля сгорает в кислороде, если при этом выделяется 2050 кДж теплоты? Тепловой эффект реакции равен 393,5 кДж. 32. Используя термохимическое уравнение реакции4NH3 (г) + 5O2 (г) = 4NO (г) + 6H2O (ж) + 1168,8 кДжопределите, какой объем аммиака (н.у.) вступит в реакцию, если образуется 584,4 кДж теплоты?33. Напишите термохимическое уравнение реакции между газообразным оксидом углерода (II) и водородом, в результате которой образуются газообразные продукты - метан СН4 и вода. Известно, что при получении 67,2 л метана (н.у.) выделилось 618,48 кДж теплоты.34. Зная, что тепловой эффект реакции горения этилена С2Н6 1411,91 кДж, вычислите количество теплоты, выделяющейся при сгорании 0,2 моль этилена. В результате реакции образуются газообразные оксид углерода (IV) и вода.35. Вычислите, сколько теплоты поглощается при взаимодействии 0,25 моль водорода с йодом если тепловой эффект реакции равен -50,8 кДж. В результате реакции образуется газообразный иодоводород.36. Рассчитайте энтальпию, энтропию, энергию Гиббса и сделайте вывод о возможности протекания этой реакции по стандартным условиям:2СО (г) + О2 (г) = СО2 (г).37. При сжигании глюкозы С6Н12О6 массой 45 г выделилось 730 кДж теплоты. Составьте термохимическое уравнение этой реакции.38. Вычислите количество теплоты и объем оксида углерода (IV) (н.у.), который образуется при сжигании 50 мл этанола С2Н5ОН плотностью 0,8 г/мл. Тепловой эффект реакции 1410 кДж.39. Рассчитайте энтальпию, энтропию, энергию Гиббса и сделайте вывод о возможности протекания этой реакции по стандартным условиям:2NO (г) + O2 (г) = 2NO2 (г).40. На основе термохимического уравнения реакции полного сгорания ацетилена:2С2Н2 + 5О2 = 4СО2 + 2Н2О + 2610 кДжРассчитайте, сколько выделится теплоты, если будет потрачено: а) 13 г ацетилена; б) 1,12 л ацетилена.41. Рассчитайте энтальпию, энтропию, энергию Гиббса и сделайте вывод о возможности протекания этой реакции по стандартным условиям:4NH3 (г) + 5O2 (г) = 4NO (г) + 6H2O (ж).
42. Определить, во сколько раз увеличится скорость прямой реакции
2NO (г) + O2 (г) = 2NO2 (г),
если концентрацию каждого из исходных веществ (O2, NO) увеличить в 6 раз?
43. Скорость некоторой реакции при уменьшении температуры с 333 до 303 К уменьшилась в 8 раз. Определить температурный коэффициент скорости этой реакции.
44. Во сколько раз увеличится скорость обратной реакции в гомогенной системе 2N2O5 (г) D O2(г) + 2N2O4(г) при увеличении давления в системе в 3 раза?
45. Во сколько раз уменьшится скорость реакции при понижении температуры на 40º, если температурный коэффициент скорости реакции равен 3?
46. На сколько градусов надо понизить температуру, чтобы скорость реакции уменьшилась в 81 раз при температурном коэффициенте скорости реакции, равном 3?
47. Во сколько раз следует увеличить концентрацию оксида углерода в системе
2CO (г) D CO2 (г) + C(к) , чтобы скорость реакции увеличилась в 16 раз?
48. При увеличении температуры на 40º скорость реакции возросла в 256 раз. Определите температурный коэффициент скорости реакции.
49. Реакция между оксидом азота (II) и хлором протекает по уравнению
2NO (г) + Cl2 (г) D 2NOCl2 (г). Во сколько раз увеличится скорость прямой реакции при увеличении концентрации обоих веществ в два раза?
50. Во сколько раз возрастает скорость некоторой химической реакции при повышении температуры от 298 до 328К, если температурный коэффициент скорости реакции равен 3?
51. Во сколько раз увеличится скорость реакции при повышении температуры на 70º, если температурный коэффициент скорости реакции равен 2?
52. Скорость реакции А + 2В = C при СА = 0,5 моль/л и СВ = 0,6 моль/л равна 1,08 моль/(л·с). Определите константу скорости реакции, л2/(моль2 ·с).
53. Равновесие в системе CO (г) + H2O (г) 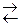 H2 (г) + CO2 (г) установилось при сле-дующих концентрациях веществ, моль/л: [CO] = 1; [H2O] = 4; [H2] = [CO2] = 2. Вычислить равновесные концентрации, которые установились после повышения концентрации CO в три раза. В каком направлении сместится равновесие?
H2 (г) + CO2 (г) установилось при сле-дующих концентрациях веществ, моль/л: [CO] = 1; [H2O] = 4; [H2] = [CO2] = 2. Вычислить равновесные концентрации, которые установились после повышения концентрации CO в три раза. В каком направлении сместится равновесие?
54. Рассчитать константу равновесия реакции CO(г) + Cl2 (г) 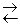 COCl2 (г), если исходные концентрации CO и Cl2 составляли 4 моль/л, а равновесная концентрация COCl2 равна 2 моль/л.
COCl2 (г), если исходные концентрации CO и Cl2 составляли 4 моль/л, а равновесная концентрация COCl2 равна 2 моль/л.
55. Равновесие в системе 2CO (г) + O2 (г) 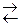 2CO2 (г) установилось при следующих концентрациях веществ, моль/л: [CO] = 1,2; [O2] = 0,1; [CO2] = 4. Вычислить исходную концентрацию CO.
2CO2 (г) установилось при следующих концентрациях веществ, моль/л: [CO] = 1,2; [O2] = 0,1; [CO2] = 4. Вычислить исходную концентрацию CO.
56. Определить направление смещения равновесия при увеличении давления в системе 2CO (г) 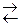 2CO2 (г) + С(г). Ответ пояснить.
2CO2 (г) + С(г). Ответ пояснить.
57. Константа равновесия процесса CO (г) + Cl2 (г) 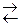 COCl2 (г) при определенных условиях равна 4. Равновесные концентрации веществ составляют, моль/л: [Cl2] = 0,5; [COCl2] = 2. Определить равновесную концентрацию CO.
COCl2 (г) при определенных условиях равна 4. Равновесные концентрации веществ составляют, моль/л: [Cl2] = 0,5; [COCl2] = 2. Определить равновесную концентрацию CO.
58. Равновесие гомогенной системы 4HCl(г) + O2(г) 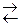 2H2O (г) + 2Cl2(г) установилось при следующих концентрациях реагирующих веществ, моль/л: [H2O] = 0,14; [Сl2] = 0,14; [HCl] = 0,20; [O2] = 0,32. Вычислите исходные концентрации хлористого водорода и кислорода.
2H2O (г) + 2Cl2(г) установилось при следующих концентрациях реагирующих веществ, моль/л: [H2O] = 0,14; [Сl2] = 0,14; [HCl] = 0,20; [O2] = 0,32. Вычислите исходные концентрации хлористого водорода и кислорода.
59. Вычислите константу равновесия для системы CO(г) + H2O(г) 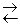 СO2(г) + H2 (г), если равновесные концентрации веществ, моль/л: [CO] = 0,004; [H2O] = 0,084; [CO2] = 0,016; [H2] = 0,016.
СO2(г) + H2 (г), если равновесные концентрации веществ, моль/л: [CO] = 0,004; [H2O] = 0,084; [CO2] = 0,016; [H2] = 0,016.
60. Константа равновесия гомогенной системы CO(г) + H2O(г) 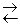 СO2(г) + H2(г) при некоторой температуре равна 1. Вычислите равновесные концентрации реаги-рующих веществ, если исходные концентрации, моль/л: СCO = 0,10; СH2O= 0,40.
СO2(г) + H2(г) при некоторой температуре равна 1. Вычислите равновесные концентрации реаги-рующих веществ, если исходные концентрации, моль/л: СCO = 0,10; СH2O= 0,40.
61. Определите молярную концентрацию 10%-ного раствора серной кислоты (ρ = 1,07 г/мл).
62. Сколько мл воды следует прибавить к 100 мл 20%-ного раствора серной кислоты (ρ = 1,14 г/мл) для получения 5%-ного раствора?
63. В каком объеме воды следует растворить 32,2 г Na2SO4×10H2O, чтобы получить 5%-ный раствор сульфата натрия?
64. Определите процентное содержание растворенного вещества 0,9 М раствора H3PO4 (ρ = 1,05 г/мл).
65. Сколько граммов медного купороса СuSO4×5H2O и воды требуется для приготовления 150 г 8%-ного раствора в расчете на безводную соль?
66. Составьте в молекулярной и ионной формах уравнения реакций взаимодействия растворов: а) гидроксида алюминия с соляной кислотой б) гидроксида алюминия с гидроксидом натрия.67. Составьте в молекулярной и ионной формах уравнения реакций взаимодействия растворов: а) гидроксида хрома (III) с серной кислотой б) гидроксида хрома (III) с гидроксидом натрия.68. Составьте в молекулярной и ионной формах уравнения реакций взаимодействия растворов: а) гидроксида свинца (II) с азотной кислотой б) нитрата свинца (II) с гидроксидом натрия.69. Составьте в молекулярной и ионной формах уравнения реакций взаимодействия растворов: а) гидрокарбоната калия с серной кислотой б) хлорида алюминия с нитратом серебра.70. Составьте в молекулярной и ионной формах уравнения реакций взаимодействия растворов: а) уксусной кислоты с гидроксидом натрия б) гидрокарбоната натрия с гидроксидом натрия.71. Составьте в молекулярной и ионной формах уравнения реакций взаимодействия растворов: а) хлорида железа (III) с гидроксидом аммония; б) гидроксида алюминия с серной кислотой.72. Составьте в молекулярной и ионной формах уравнения реакций взаимодействия растворов: а) хлорида алюминия с нитратом серебра; б) гидроксида цинка с гидроксидом натрия.73. Составьте молекулярные уравнения для реакций, выражающихся следующими сокращенными ионными уравнениями:а) Pb2+ + 2I- = PbI2; б) Fe(OH)3 + 3H+ = Fe3+ + 3H2O.
74. Составьте молекулярные уравнения для реакций, выражающихся следующими сокращенными ионными уравнениями:а) H+ + ОH- = H2О; б) Cd2+ + S2- = CdS.
75. Составьте молекулярные уравнения для реакций, выражающихся следующими сокращенными ионными уравнениями:а) Сu2+ + S2- = СuS; б) Al(OH)3 + 3H+ = Al3+ + 3H2O.
76. Составьте молекулярные уравнения для реакций, выражающихся следующими сокращенными ионными уравнениями:а) Со2+ + S2- = СuS; б) Ba2+ + SO42- = BaSO4.
77-97. Напишите в молекулярной и ионной формах уравнения реакций гидролиза солей, укажите значения рН растворов этих солей (больше или меньше семи).
| 77. NaNO2, Cu(NO3)2 | 87. Na2HPO4, Mg(NO3)2 |
| 78. AlCl3, NaHCO3 | 88. Al2 (SO4)3, Na2SeO3 |
| 79. Na3PO4, ZnCl2 | 89. CuSO4, K3PO4 |
| 80. FeCl2, K2S | 90. Na2SO3, Fe2 (SO4)3 |
| 81. K2SO3, ZnSO4 | 91. NaCN, FeSO4 |
| 82. NH4Cl, KClO | 92. Ba(CH3COO)2, CoSO4 |
| 83. Na2Se, MnCl2 | 93. NiSO4, NaF |
| 84. ZnSO4, BaS | 94. Pb(NO3)2, Ba(NO2)2 |
| 85. Ni (NO3)2, KNO2 | 96. Cr2(SO4)3, Na CH3COO |
| 86. NH4Br, Na2S | 97. KHS, MgSO4 |
98. Раствор камфоры массой 0,552 г в 17 г эфира кипит при температуре на 0,4610С выше, чем чистый эфир. Эбулиоскопическая постоянная эфира 2,160С. Определите молекулярную массу камфоры.
99. Определите температуру кипения и замерзания раствора, содержащего 1 г нитробензола С6Н5NO2 в 10 г бензола. Эбулиоскопическая и криоскопическая константы соответственно равны 2,57 и 5,10С. Температура кипения чистого бензола 80,20С, температура замерзания –5,40С.
100. 25 г неэлектролита (Мr = 210 г/моль) растворили в 75 г воды. При какой температуре закипит этот раствор?
Задания 101-129. Составьте электронный баланс, укажите окислитель, восстановитель и процессы, расставьте коэффициенты:101. а) K2S + KMnO4 + H2SO4 ® S + MnSO4 + K2SO4 + H2O;
б) Cu + H2SO4 ® CuSO4 + SO2 + H2O.
102. а) Zn + K2Cr2O7 + H2SO4 ® ZnSO4 + Cr2(SO4)3 + K2SO4 + H2O;
б) Mg + H2SO4 ® MgSO4 + H2S + H2O.
103. а) SnSO4 + KMnO4 + H2SO4 ® Sn(SO4)2 + MnSO4 + K2SO4 + H2O;
б) K + H2SO4 ® K2SO4 + S + H2O.
104. а) NaI + KMnO4 + KOH ® I2 + K2MnO4 + NaOH;
б) Ag + HNO3 ® AgNO3 + NO2 + H2O.
105. а) S + KClO3 + H2O ® Cl2 + K2SO4 + H2SO4;
б) Cu + HNO3 ® Cu(NO3)2 + NO + H2O.
106. а) Na2SO3 + KIO3 + H2SO ® I2 + Na2SO4 + K2SO4 + H2O;
б) Ca + HNO3 ® Ca(NO3)2 + N2O + H2O.
107. а) Na2SO3 + KMnO4 + KOH ® Na2SO4 + K2MnO4 + H2O;
б) Mg + HNO3 ® Mg(NO3)2 + N2 + H2O.
108. а) HNO3 ® NO2 + O2 + H2O;
б) Mg + HNO3 ® Mg(NO3)2 + NH4NO3 + H2O.
109. а) K2MnO4 + CO2 ® KMnO4 + MnO2 + K2CO3;
б) Fe + HNO3 ® Fe(NO3)3 + NO2 + H2O.
110. а) KClO3 ® KClO4 + KCl;
б) H2S + HNO3 ® S + NO2 + H2O.
111. а) Cl2 + KOH ® KCl + KClO3 + H2O;
б) KNO2 + KClO3 ® KCl + KNO3.
112. а) S + KOH ® K2S + K2SO3 + H2O;
б) SO2 + HNO3 + H2O ® H2SO4 + NO.
113. а) Na2SO3 ® Na2S + Na2SO4;
б) KClO3 + S ® KCl + SO2.
114. а) Cl2 + Br2 + KOH ® KCl + KВrO3 + H2O;
б) NaI + NaIO3 + H2SO4 ® I2 + Na2SO4 + H2O.
115. а) C + HNO3 ® CO2 + NO + H2O;
б) Mg + HNO3 ® Mg(NO3)2 + N2 + H2O.
116. а) H2S + K2Cr2O7 + H2SO4 ® S + Cr2(SO4)3 + K2SO4 + H2O;
б) KNO2 + KI + H2SO4 ® I2 + NO + K2SO4 + H2O.
117. а) HCl + MnO2 ® Cl2 + MnCl2 + H2O;
б) Zn + HNO3 ® N2 + Zn(NO3)2 + H2O.
118. а) HCl + KMnO4 ® Cl2 + MnCl2 + KCl + H2O;
б) H2S + H2SO4 ® S + H2O.
119. а) MnO2 + O2 + KOH ® K2MnO4 + H2O;
б) Fe2O3 + Al ® Fe + Al2O3.
120. а) MnO2 + H2SO4 ® MnSO4 + O2 + H2O;
б) Cu + H2SO4(конц) ® CuSO4 + SO2 + H2O.
121. а) AgNO3 ® Ag + NO2 + O2;
б) KClO3 ® KCl + KClO4.
122. а) Fe2O3 + KNO3 + KOH ® K2FeO4 + KNO2 + H2O;
б) Na2SO3 + KMnO4 + H2SO4 ® Na2SO4 + K2SO4 + MnSO4 + H2O.
123. а) K2Cr2O7 + HCl ® KCl + CrCl3 + Cl2 + H2O;
б) Br2 + Cl2 + KOH ® KBrO3 + KCl + H2O.
124. а) K2Cr2O7 + H2S + H2SO4 ® K2SO4 + Cr2(SO4)3 + S + H2O;
б) KMnO4 + SO2 + H2O ® K2SO4 + MnSO4 + H2SO4.
125. а) Na2S2O3 + Cl2 + H2O ® H2SO4 + NaCl + HCl;
б) CuS + HNO3 ® Cu(NO3)2 + S + NO2 + H2O.
126. а) KMnO4 + KNO2 + H2SO4 ® KNO3 + K2SO4 + MnSO4 + H2O;
б) FeSO4 + K2Cr2O7 + H2SO4 ® K2SO4 + Cr2(SO4)3 + H2O + Fe2(SO4)3.
127. а) H2O2 + HJO3 ® J2 + O2 + H2O;
б) FeCl2 + KMnO4 + HCl ® FeCl3 + Cl2 + MnCl2 + KCl + H2O.
128. а) H2O2 + CrCl3 + KOH ® K2CrO4 + KCl + H2O;
б) KNO2 + KJ + H2SO4 ® J2 + NO + K2SO4 + H2O.
129. а) H2O2 + KMnO4 + HNO3 ® Mn(NO3)2 + O2 + KNO3 + H2O;
б) KMnO4 + NO + H2SO4 ® MnSO4 + NO2 + K2SO4 + H2O.
130. а) H2S + KMnO4 + H2SO4 ® S + MnSO4 + K2SO4 + H2O;
б) Ag + HNO3 ® AgNO3 + NO2 + H2O.
131-150. Рассмотрите катодные и анодные процессы при электролизе водных растворов веществ. Составьте схемы электролиза с инертными электродами водных растворов предложенных соединений (отдельно два раствора) с инертными электродами. Рассчитайте массу или объем (при нормальных условиях для газов) продуктов, выделяющихся на электродах при пропускании через раствор в течение 1 часа тока силой 1 А.
| 131. LiBr; AgF | 132. Al2(SO4)3; NaCl |
| 133. K3PO4; Pb(NO3)2 | 134. Cо(NO3)2; KI |
| 135. Ba(NO3)2; SnSO4 | 136. NiSO4; NaNO2 |
| 137. Cr(NO3)3 ; CuCl2 | 138. FeBr2; NaOН |
| 139. Ca(NO3)2; NiSO4 | 140. ZnCl2; CoBr2 |
| 141. K2CO3; CoSO4 | 142. NiSO4; MgCl2 |
| 143. СоCl2; HNO3 | 144. BeSO4; Ba(NO2)2 |
| 145. AgNO3; Ti2(SO4)3 | 146. Mg(NO3)2; Na2CO3 |
| 147. BaCl2; Mn(NO3)2 | 148. KOH; ZnSO4 |
| 149. Pb(NO3)2; H2SO4 | 150. CaI2; Cr2(SO4)3 |
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|