
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Основания, их классификация
45. Основания, их классификация
| На сегодняшнем занятии мы рассмотрим классификацию одного из основных классов неорганических соединений – оснований. Вспомним из предыдущего занятия определение оснований: Основания – это сложные вещества, состоящие из ионов металлов и связанных с ними гидроксид-ионов. Все основания – это твердые вещества различные по окраске: гироксид кальция Ca(OH)2 – белого цвета; гидроксид меди (II) Cu(OH)2– голубого цвета; гидроксид никеля (II) Ni(OH)2 – зеленого цвета; гидроксид железа (III) Fe(OH)3– красно-бурого цвета. Единственное жидкое основание – гидроксид аммония NH4OH, или водный раствор аммиака. |
| По растворимости в воде щелочи делятся на растворимые и нерастворимые. Растворимость оснований в воде узнается из уже известной нам ранее таблицы растворимости кислот, оснований и солей в воде. Например. Проведем опыт.Поместим в одну пробирку белый гидроксид бария барий Вa(OH)2, в другую - красно-бурый порошок гидроксида железа (III) Fe(OH)3. Добавим в обе пробирки воды. В первой пробирке происходит полное растворение гироксида с образованием щелочи. Во второй пробирке реакции не наблюдается. Таким образом, гидроксид бария является растворимым в воде гидроксидом, а гидроксид железа три – нерастворимым. Перечислим другие растворимые и нерастворимые в воде основания. Растворимые: LiOH– гидроксид лития, KOH – гидроксид калия, NaOH– гидроксид натрия, NH4OH– гироксид аммония, Ba(OH)2 – гидроксид бария. Нерастворимые: Al(OH)3 – гидроксид алюминия, Mg(OH)2 – гидроксид магния, Fe(OH)2 – гидроксид железа (II), Zn(OH)2 – гидроксид цинка, Cu(OH)2 – гидроксид меди (II). |
По степени электролитической диссоциации основания делятся на сильные и слабые.
Сильные основания, в первую очередь щелочи, в водных растворах полностью диссоциируют на отдельные ионы (катионы металла и гидроксид-анионы).
Например, гидроксид натрия в водном растворе полностью диссоциирует на катионы натрия и гидроксид-анионы:
NaOH → Na+ + OH-.
То есть в водном растворе вещество гидроксид натрия находится в виде ионов. Именно наличие в растворе гидроксид-анионов ОН-обуславливает ряд общих свойств оснований: мылкость на ощупь, изменение окраски индикаторов (лакмуса, метилового оранжевого и фенолфталеина), химические свойства.
У слабодиссоциирующих оснований при растворении в воде в растворе одновременно присутствуют и ионы и молекулы вещества. Поэтому диссоциация никогда не проходит до конца:
NH4OH 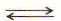 NH4+ + OH-.
Перечислим некоторые сильные и слабые основания.
Сильные: LiOH– гидроксид лития, KOH– гидроксид калия, NaOH – гидроксид натрия.
Слабые: NH4OH– гироксид аммониия. NH4+ + OH-.
Перечислим некоторые сильные и слабые основания.
Сильные: LiOH– гидроксид лития, KOH– гидроксид калия, NaOH – гидроксид натрия.
Слабые: NH4OH– гироксид аммониия.
|
| По числу гидроксогрупп основания делятся на однокислотные, двухкислотные и трехкислотные. Однокислотные основаниясодержат в составе своей молекулы одну гидроксид группу ОН. Например: LiOH– гидроксид лития, KOH– гидроксид калия, NaOH – гидроксид натрия. Двухкислотные основаниясодержат в составе своей молекулы две гидроксид группы ОН. Например: Ba(OH)2 – гидроксид бария, Mg(OH)2– гидроксид магния, Fe(OH)2– гидроксид железа (II). Трехкислотные основаниясодержат в составе своей молекулы три гидроксид группы ОН. Например: Al(OH)3– гидроксид алюминия, Fe(OH)3. При электролитической диссоциации основания диссоциируют на катионы металла и гидроксо-группы. Например, проведем диссоциацию однокислотных, двухкислотных и трехкислотных оснований. Однокислотное: LiOH = Li+ + OH- – при диссоциации молекулы однокислотного основания образуется один гидроксид-анион; Двухкислотное: Ba(OH)2 = Ba2+ + 2OH-– при диссоциации молекулы двухкислотного основания образуется два гидроксид-аниона; Трехкислотное: Al(OH)3 = Al3+ + 3OH- - при диссоциации молекулы трехкислотного основания образуется три гидроксид-аниона. |
| ВЫВОД:Классификация оснований основана на их растворимости в воде, степени электролитической диссоциации и числе гидроксогрупп. Общие свойства оснований основаны на наличии гидроксогрупп ОН. |
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|