- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Химические свойства кислот
Классификация и химические свойства кислот в свете ТЭД
кислоты - это электролиты, образующие при диссоциации катионы водорода Н+ и анионы кислотного остатка.
Кислоты
   Кислородсодержащие Бескислородные
H2SO4, HNO3 HCl, HBr, H2S
Кислородсодержащие Бескислородные
H2SO4, HNO3 HCl, HBr, H2S
  Одноосновные Многоосновные
НСl, HNO3 H2S, H3PO4
Одноосновные Многоосновные
НСl, HNO3 H2S, H3PO4
  Растворимые Нерастворимые
H2SO4, HNO3 Н2SiO3
Растворимые Нерастворимые
H2SO4, HNO3 Н2SiO3
Летучие Нелетучие НСl, HNO3, H2S, H2SO4, Н2SiO3,
Сильные Средние Слабые HClO4, H2SO4, HNO3, H3PO4, Н2SO3, HF, H2S, H2CO3, H2SiO3, HCl, HBr, HI HNO2
|
Химические свойства кислот
Кислоты проявляют общие свойства: имеют кислый вкус, одинаково изменяют цвет индикаторов, взаимодействуют с металлами, основными оксидами, основаниями и солями.
Общие свойства всех кислот связаны с наличием в их растворах катионов водорода Н+. HNO3 → H+ + N 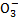 ;
;
HCl → H+ + Cl─
1. Изменяют цвет индикаторов: HCl → H+ + Cl ─
H+ + лакмус(фиолетовый) → красный
H+ + фенолфталеин(б/цв) → не изменяет цвет
H+ + метиловый-оранжевый → розовый
2. Все кислоты: сильные и слабые, растворимые и нерастворимые взаимодействуют со щелочами - реакция нейтрализации
HCl + NaOH → NaCl + H2O
 H+ + Cl─ + Na+ + OH ─ → Na+ + Cl─ + H2O
H+ + Cl─ + Na+ + OH ─ → Na+ + Cl─ + H2O
H+ + OH ─ → H2O
3. Сильные кислоты взаимодействуют с нерастворимыми основаниями и амфотерными гидроксидами.

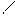 а) H2SO4 + Cu(OH)2 → CuSO4 + 2H2O
а) H2SO4 + Cu(OH)2 → CuSO4 + 2H2O
2H+ + 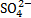 + Cu(OH)2 → Cu2+ +
+ Cu(OH)2 → Cu2+ + 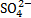 + 2H2O
+ 2H2O
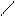
 2H+ + 2Cl ─ + CaO → Ca2+ +2Cl ─ + H2O
2H+ + CaO → Ca2+ + H2O
б) 2HCl + ZnO → ZnCl2 + H2O
2H+ + ZnO → Zn2+ + H2O
5. Растворы кислот взаимодействуют с металлами, стоящими в ряду напряжений до Н2, если образуется растворимая соль.
Zn + 2HCl → ZnCl2 + H2↑
2H+ + 2Cl ─ + CaO → Ca2+ +2Cl ─ + H2O
2H+ + CaO → Ca2+ + H2O
б) 2HCl + ZnO → ZnCl2 + H2O
2H+ + ZnO → Zn2+ + H2O
5. Растворы кислот взаимодействуют с металлами, стоящими в ряду напряжений до Н2, если образуется растворимая соль.
Zn + 2HCl → ZnCl2 + H2↑
 Zn0 + 2H+ + 2Cl─ → Zn2+ + 2Cl─ + H20
Zn0 + 2H+ → Zn2+ + H20
6. Растворимые кислоты взаимодействуют с растворами средних, кислых, основных солей, образованных более слабыми кислотами или если образуются осадок, газ.
а) 2HCl + Na2CO3 → 2NaCl + H2O + CO2↑
Zn0 + 2H+ + 2Cl─ → Zn2+ + 2Cl─ + H20
Zn0 + 2H+ → Zn2+ + H20
6. Растворимые кислоты взаимодействуют с растворами средних, кислых, основных солей, образованных более слабыми кислотами или если образуются осадок, газ.
а) 2HCl + Na2CO3 → 2NaCl + H2O + CO2↑
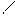
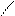
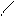 2H+ + 2Cl ─ + 2Na+ +
2H+ + 2Cl ─ + 2Na+ + 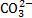 → 2Na+ + 2Cl─ + H2O + CO2↑
2H+ +
→ 2Na+ + 2Cl─ + H2O + CO2↑
2H+ + 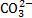 → H2O + CO2↑
→ H2O + CO2↑
 2HCl + Na2SiO3 →2NaCl + H2SiO3↓
2HCl + Na2SiO3 →2NaCl + H2SiO3↓
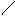
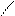
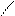 2H+ + 2Cl ─ + 2Na+ +
2H+ + 2Cl ─ + 2Na+ + 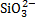 → 2Na+ + 2Cl─ + H2SiO3↓
2H+ +
→ 2Na+ + 2Cl─ + H2SiO3↓
2H+ + 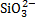 → H2SiO3↓
б) Mg(HCO3)2 + 2HCl → MgCl2 + 2H2O + 2CO2↑
2
→ H2SiO3↓
б) Mg(HCO3)2 + 2HCl → MgCl2 + 2H2O + 2CO2↑
2 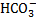 + 2H+ → 2H2O + 2CO2↑
в) (СuOH)2CO3 + 2H2SO4 → 2CuSO4 + 3H2O + CO2↑
(СuOH)2CO3 + 4 H+ → Cu2+ + 3H2O + CO2↑
+ 2H+ → 2H2O + 2CO2↑
в) (СuOH)2CO3 + 2H2SO4 → 2CuSO4 + 3H2O + CO2↑
(СuOH)2CO3 + 4 H+ → Cu2+ + 3H2O + CO2↑