
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
При увеличении объема в системе в 3 раза скорость химической реакции СН4 + 2О2 = СО2 + 2Н2О:
1. При увеличении объема в системе в 3 раза скорость химической реакции СН4 + 2О2 = СО2 + 2Н2О:
1. увеличится в 9 раз
2. увеличится в 27 раз
3. уменьшится в 27 раз
4. не изменится
2. Температурный коэффициент реакции равен 2, при повышении температуры от 30°C до 50°C скорость реакции
1. увеличивается в 4 раза
2. увеличивается в 6 раз
3. уменьшается в 4 раза
4. уменьшается в 2 раза
3. Коэффициент перед молекулой окислителя в уравнении реакции КNO3 + H2SO4 + KJ = K2SO4 + J2 + NO + H2O
1. 1
2. 2
3. 3
4. 4
4. Мерой неупорядоченности системы, отражающей движение частиц вещества, является:
1. энтальпия
2. энтропия
3. теплота
4. энергия Гиббса
5. Капрон получают в результате реакции:
1. поликонденсации
2. вулканизации
3. полимеризации
4. сополимеризации
6. Синтетическим полимером является:
1. полистирол
2. белок
3. крахмал
4. целлюлоза
7. Реакции называются гомогенными:
1. протекающие между веществами, находящимися в разных фазах
2. протекающие с изменением степени окисления
3. протекающие между ионами в водных растворах электролитов
4. протекающие между веществами, находящимися в одной фазе
8. Объем 0,1н раствора КОН, необходимый для нейтрализации 20 мл 0,15н раствора азотной кислоты, равен:
1. 30 мл
2. 20 мл
3. 15 мл
4. 45 мл
9. рН 0,01 м раствора гидроксида натрия при 100% диссоциации:
1. 2
2. 6
3. 10
4. 12
10. В состоянии sp²-гибридизации находится молекула:
1. СF4
2. СO2
3. ВеН2
4. BСl3
11. С увеличением температуры энергия активации молекул:
1. уменьшается
2. не изменяется
3. возрастает
4. изменяется периодически
12. Число неспаренных электронов в атоме брома, находящегося в основном состоянии, равно:
1. 2
2. 1
3. 6
4. 5
13. Веществом Х2 в цепочке превращений 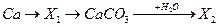 является:
является:
1. Ca(HCO3)2
2. CaO
3. Ca(OH)2
4. CaC2O4
14. При взаимодействии оксида серы (IV) с избытком раствора NaOH образуется:
1. сульфит натрия и вода
2. гидросульфит натрия
3. гидросульфат натрия
4. сульфат натрия и вода
15. Уравнение процесса, протекающего на аноде при электролизе водного раствора бромида кальция:
1. 2H2O + 2e = H2 + 2OH-
2. 2H+ + 2e = H2
3. 2Br--2e = Br2
4. Ca2+ + 2e = Ca˚
16. К 200 г. раствора, содержащего 80 г. нитрата калия, добавили 800 мл воды. Массовая доля соли в полученном растворе составляет, %:
1. 6
2. 8
3. 10
4. 12
17. Электролиз раствора нитрата серебра проводили при силе тока 2А в течение 1 часа. Сколько граммов серебра выделилось на катоде:
1. 4,0
2. 8,0
3. 12,0
4. 14,0
18. Какие из перечисленных металлов могут образовывать катодное покрытие на никеле:
1. цинк, магний
2. хром олово
3. олово, медь
4. магний, медь
19. Какие степени окисления характерны для хрома в его соединениях:
1. 2, 4, 6
2. 2,4
3. 3, 6
4. 2, 3, 6
20. Укажите, какая из перечисленных солей имеет в водном растворе рН меньше 7:
1. сульфат натрия
2. нитрат аммония
3. сульфит натрия
4. хлорид калия
21. Сокращенное ионное уравнение Н++ОН-=Н2О соответствует реакции:
1. 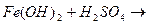
2. 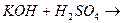
3. 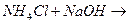
4. 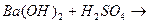
22. Стандартный окислительно-восстановительный потенциал полуреакции 2Н++2е=Н2 принят равным, В:
1. 0
2. 1
3. 8,31
4. 0,059
23. Орбитальное квантовое число может принимать значения:
1. – l, …,0,… + l
2. 0, …, (n– 1)
3. 1, 2, 3, …∞
4. ± ½
24. Сколько граммов гидроксида кальция содержится в 100 мл раствора с молярной концентрацией эквивалента 0,2 моль/л:
1. 0,37
2. 0,74
3. 0,11
4. 1,48
25. В системе 2Fe( к ) + 3Н2О( г ) ↔ Fe2O3( к ) + 3Н2( г ) для прямой реакции изменение энтальпии ΔН = - 96,74 кДж/моль; изменение энтропии ΔSо = - 141,5 Дж/моль· К; Рассчитайте значение энергии Гиббса и сделайте вывод о возможности самопроизвольного протекание реакции в прямом направлении.
ΔG = ________________________
Самопроизвольное протекание реакции _____________
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|