
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Тема Периодический закон и периодическая система химических элементов Д.И. Менделеева
Тема Периодический закон и периодическая система химических элементов Д.И. Менделеева
Изучите теоретический материал, напишите конспект и ответьте на вопросы.
Периодическая система – это графическое изображение закона периодичности.
Сведения, которые можно получить о каждом элементе из периодической таблицы элементов: порядковый (атомный номер), символ элемента, название элемента, относительная атомная масса, распределение электронов по слоям.
Порядковый номер = Численный заряд ядра = Число протонов = Число электронов
Основными структурными единицами системы элементов являются период и группа.
Период –это горизонтальный ряд элементов, в котором имеет место закономерное изменение свойств элементов от типично металлических к типично неметаллическим и далее к благородным газам.
Номер периода = Число заполненных электронных слоёв = Номер внешнего электронного слоя
В таблице семь периодов. В 1-м периоде всего два элемента. Во 2-м и 3-м периодах содержится по восемь элементов. Это малые периоды. Затем идут большие периоды: в 4-м и 5-м периодах – восемнадцать элементов, в 6-м – тридцать два элемента, а в 7-м (последнем) пока известно двадцать восемь химических элементов.
В системе 10 рядов. Малые периоды состоят из одного ряда. Большие периоды – из двух рядов: верхний ряд – чётный, нижний – нечётный.
Группы периодической системы (вертикальные столбцы) содержат элементы, свойства которых подобны. Каждая группа состоит из двух подгрупп: главной и побочной.
Подгруппы, в которые входят элементы малых и больших периодов, называются главными.
Подгруппы, в которые входят элементы только больших периодов, называются побочными.
Элементы, имеющие одинаковое число внешних электронов, стоят в одной и той же группе.
Номер группы = Число внешних электронов
Правила написания электронной формулы
1.Число электронных слоёв в атоме определяется номером периода, в котором находится элемент.
2.Число электронов на внешнем уровне для элементов главных подгрупп равно номеру группы.
3.У атомов элементов побочных подгрупп сначала заполняется предвнешний уровень, а затем снова внешний.
Пример описания химического элементаРубидий.
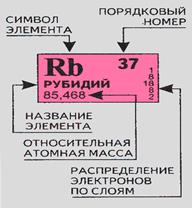
1.
2.Период 5
Ряд 5
Группа I
Подгруппа главная
Металл
Порядковый№ 37
Относительная атомная масса-85,47
3.37Rb ) ) ) ) )
2 8 18 8 1
4.1s2 ; 2s2; 2p6; 3s2; 3p6; 3d10; 4s24p65s24p6; 5s1
Вопросы для закрепления теоретического материала
1. Сформулируйте закон периодичности.
2. Почему число элементов в периодах соответствует ряду чисел 2-8-18-32?
3. На основе теории строения атомов поясните, почему группы элементов разделены на главные и побочные.
4. По каким признакам различают s-; p-; d-; f-элементы?
5. Почему численное значение валентности не всегда совпадает с числом электронов на наружных энергетических уровнях?
Ответы присылаем на адрес электронной почты:
20Nizamova20@bk.ru
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|