
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Теория. Задачи для самоконтроля
Теория
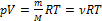 =
= 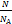 - уравнение Менделеева-Клапейрона. Применяется в любом случае, особенно удачно подходит для газа, масса которого меняется. Смотри задачу №1
- уравнение Менделеева-Клапейрона. Применяется в любом случае, особенно удачно подходит для газа, масса которого меняется. Смотри задачу №1
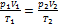 - уравнение Клапейрона. Применяется для газа неизменной массы при изменении его о сновных параметров: давления р, объема V или температуры Т. Смотри задачу №2
- уравнение Клапейрона. Применяется для газа неизменной массы при изменении его о сновных параметров: давления р, объема V или температуры Т. Смотри задачу №2
Из ур-ия Клапейрона получаются три газовых закона:
 При постоянной температуре газа Т=соnst (изотермический процесс) ур-ие принимает вид р1∙V1=p2∙V2 – закон Бойля-Мариотта. Смотри задачу №3 График этого закона называется изотермой.
При постоянной температуре газа Т=соnst (изотермический процесс) ур-ие принимает вид р1∙V1=p2∙V2 – закон Бойля-Мариотта. Смотри задачу №3 График этого закона называется изотермой.
Очень важно! Если процесс изотермический, то давление газа обратно пропорционально температуре, то есть если давление увеличивается, то объем уменьшается и наоборот. Таким образом р  V
V 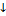 или р
или р 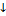 V
V 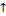

При постоянном давлении газа р=соnst (изобарный процесс) уравнение Клапейрона принимает вид 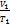 =
= 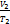 – закон Гей-Люссака. Смотри задачу №4 График этого закона называется изобарой.
– закон Гей-Люссака. Смотри задачу №4 График этого закона называется изобарой.
Важно! Если процесс изобарный, то объем газа прямопропорционален температуре, то есть если объем газа растет, то и температура тоже и наоборот. Таким образом V 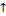 Т
Т 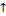 или V
или V 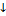 Т
Т 
 При постоянном объеме газа V= соnst (изохорный процесс) ур-ие Клапейрона принимает вид
При постоянном объеме газа V= соnst (изохорный процесс) ур-ие Клапейрона принимает вид  =
=  - закон Шарля. Смотри задачу №5 График этого закона называется изохорой.
- закон Шарля. Смотри задачу №5 График этого закона называется изохорой.
Важно! Если процесс изохорный, то давление прямопропорционально температуре газа, то есть эти параметры изменяются всегда в одну сторону, что означает р 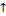 Т
Т 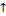 или р
или р 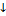 Т
Т 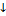
Рассмотрим несколько газов, которые находятся в одной емкости. Это называется смесь газов. В таком случае у всех газов, входящих в смесь, общими будут объем и температура. Масса смеси m=m1+m2+m1+… Давление смеси газов р=р1+р1+р3+… - закон Дальтона!!!. Молярная масса смеси М 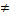 сумме молярных масс газов, входящих в эту смесь. Ее следует находит через применение ур-ия Менделеева-Клапейрона
сумме молярных масс газов, входящих в эту смесь. Ее следует находит через применение ур-ия Менделеева-Клапейрона 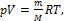 где m=m1+m2+m1+… , р=р1+р1+р3+…
где m=m1+m2+m1+… , р=р1+р1+р3+…
Плотность смеси газов ρ=  Смотри задачу №6
Смотри задачу №6
1.В открытом сосуде находится 120 г некоторого идеального газа. Если при нагревании газа от температуры 300 К до температуры 450 К, давление газа остается неизменным, то из сосуда выходит…г газа
2.Если известно, что объем, занимаемый определенной массой идеального газа, уменьшили на 20%, его температуру уменьшили на 24 К, а давление возросло при этом на 20%, то начальная температура газа составляла 1)24 К 2)300 К 3)324 К 4)576 К 5)600 К
3.В ходе изотермического процесса давление идеального газа уменьшилось на 150 кПа. Если известно, что объем газа увеличился в 4 раза, то его конечное давление составляет 1)10 кПа 2)20 кПа 3)30 кПа 4)40 кПа 5)50 кПа
4.На сколько необходимо увеличить температуру идеального газа при изобарном нагревании, чтобы его объем увеличился на 25% по сравнению с объемом при t1=270с?
5.Чтобы давление определенной массы идеального газа при постоянном объеме уменьшилось в 1,25 раза, его температуру следует уменьшить на 1)20% 2)25% 3)37,5% 4(50% 5)60%
6.Смесь газов состоит из m1=0,50 кг водорода, М1=2,0 г/моль, гелия массой m2=1,6 кг и молярной массой M2=4,0 г/моль, а также кислорода m3=8,0 кг и М3=32 г/моль. Средняя молярная масса М смеси составляет 1)5,8 г/моль 2)7,4 г/моль 3)8,0 г/моль 4)8,8 г/моль 5)11 г\моль
Задачи для самоконтроля
1.Идеальный газ изотермически сжали, уменьшив его объем в 2 раза. Определите конечное давление газа, если начальное р1=3 кПа
2.Во сколько раз и в какую сторону изменится плотность идеального газа при изменении его давления от 80 кПа до 160 кПа в ходе изотермического процесса.
3.При изохорном охлаждении идеального газа его давление уменьшилось в 3 раза. Определите начальную температуру, если конечная Т2=250 К.
4.При какой температуре находился идеальный газ, если при изобарном нагревании на ∆Т=50 К его объем изменился на 20% от начального?
5.В сосуде содержится сжатый идеальный газ при температуре Т1=300 К и давлении р1=1,5 МПа. Определите давление газа, если из сосуда выпустили теть его массы, а температуру понизили до Т2=270 К
6.В сосуде емкостью V=50 л находится кислород О2 массой m=1,6 г. Определите давление газа при температуре t=1270С. Молярная масса кислорода М=32 г\моль.
7.Определить плотность смеси, состоящей из 4 граммов водорода и 32 граммов кислорода при давлении 7°С и давлении 93кПа?
8*.Объем пузырька воздуха, всплывающего на поверхность со дна озера, увеличивается в 3,5 раза. Определите глубину озера, если атмосферное давление р0=100 кПа. Температура воды одинакова во всем объеме водоема. Плотность воды ρ=1000 кг/м3, g=10 м/с2. Примечание. Применить закон изотермического процесса, также воспользовавшись формулой гидростатического давления р=ρgh. В качестве газа взять воздух внутри пузырька.
 Графические задачи
Графические задачи
1.Идеальный газ совершает замкнутый цикл, приведенный на рисунке. Температура газа уменьшается на участках: 1) 1-2 2) 2-3 3) 3-1 4) 2-3 и 3-1
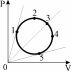
2.Идеальный газ совершает замкнутый цикл, приведенный на рисунке. Температура газа максимальна в точке:
1) 1 2) 2 3) 3 4)4
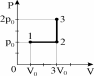
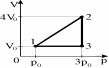
3.Постоянную массу ид-го газа переводят из сост. 1 в состояние 3, как показано на рисунке. Если в состоянии 1 температура газа была равна 100 К, то в состоянии 3 она станет равной: 1) 600 К 2) 300 К 3) 150 К 4) 100 К
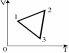
4.Идеальный газ совершает замкнутый цикл, приведенный на рисунке. Давление газа уменьшается на участках: 1) 1-2 2) 2-3 3) 3-1 4) 1-2 и 2-3

5.На каком из графиков изохорный процесс в идеальном газе? Выберите правильный ответ. 1) А 2) Б 3) В 4) среди ответов нет верного
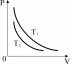
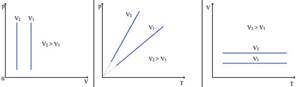
6.На рисунке изображены две изотермы для двух газов. Газы можно считать идеальными. Сравнить T1 и T2. Массы газов постоянны. 1) T1=T2 2) T1<T2 3) T1>T2 4) среди ответов нет верного
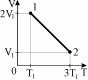
7.Идеальный газ совершает процесс 1-2, приведенный на рисунке. Как при этом изменилось давление газа?
1) р2=3р1 2) р2=6р1 3) р2=2р1 4) р2=0,5р1
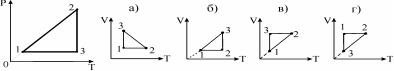
8.Постройте график процесса, происходящего с идеальным газом в координатах р,Т, в координатах V,T. Масса газа постоянная
1) а) 2) б) 3) в) 4) г)
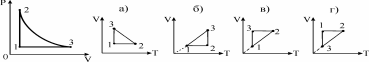
9.Постройте график процесса, происходящего с идеальным газом в координатах р,V, в координатах V,T. Масса газа постоянная.
1) а) 2) б) 3) в) 4) г) 5) д)
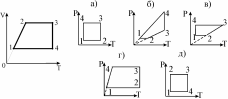
10.Постройте график процесса, происходящего с идеальным газом в координатах V,Т, в координатах р,T. Масса газа постоянная. 1) а) 2) б) 3) в) 4) г)
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|