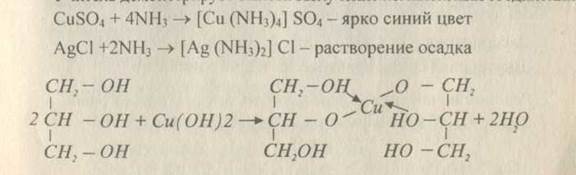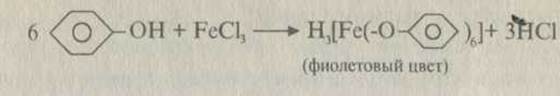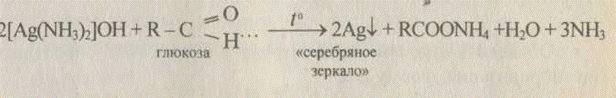- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Лекция . Понятие о комплексных соединениях.
Лекция . Понятие о комплексных соединениях.
Цель:сформировать представление учащихся о составе, строении, номенклатуре, видах и классификации комплексных соединений; научить давать названия комплексным соединениям по формулам, составлять формулы по названиям.
Оборудование:растворы глицерина, CuS04, NaOH, FeCb, фенола, FeS04, ВаС12, желтой и красной кровяных солей, аммиака, НС1, глюкозы, AgN03, NaCl, Nal; спиртовка, пробирки, спички, зажим.
План
Комплексообразование. Понятие о комплексных соединениях.
Координационное число комплексообразователя.
Внутренняя и внешняя сфера комплексов.
Номенклатура комплексных соединений. Их значение.
Лекция:Комплексные соединения распространены в природе (это гемоглобин и хлорофилл), используются в аналитической химии, в медицине, технике, в химической промышленности как катализаторы.
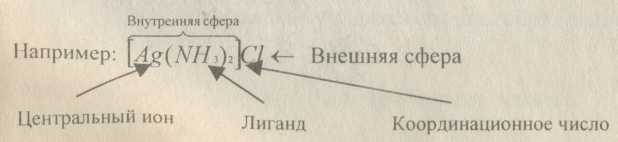
Комплексные соединения - это сложные вещества, в которых можно выделить внутреннюю сферу, в которую входят: центральный атом (ион) - комплексообразователь; связанные с ним донорно- акцепторными связями лиганды; и внешнюю сферу, связанную с внутренней ионной связью.
Число лигандов во внутренней сфере называется координационным числом.
Координационное число зависит от заряда центрального иона, и, как правило, в 2 раза больше него.
|
|
Форма комплексного иона определяется типом гибридизации атомных орбиталей центрального иона:
У иона Ag на внешнем уровне нет электронов, по донорно- акцепторному механизму на s и р-орбитали присоединяются молекулы аммиака. Теперь у серебра задействованы 2 орбитали, значит гибридизация sp, комплекс имеет линейную форму. Теория строения комплексных веществ предложена А. Вернером
| Заряд центрального | Координационное число | Форма комплексного иона | Примеры |
| +1 +2 | (редко 6) | Линейная Тетраэдрическая Плоская квадратная | [Ag (NH3)2]C1; Na [Ag(CN)2] [Cu(NH3)4]S04 [PtCl2(NH3)2]° K4 [Fe(CN)6] |
| +3 | (редко 4) | Откаэдрическая Редко шестиугольная призматическая | K3 [Al(OH)6] К [A1 (OH)„] |
Комплексные соединения бывают: а) анионные (комплексный анион); б) катионные (комплексный катион); в) катионанионные (комплексные анион и катион); г) нейтральные (комплексная группа нейтральна).
Примеры: а) К, [Fe(CN)6]; б) [Cu(NH3)4]S04; в) [Cu(NH3)4] [PtCl*]; г) [Fe(CO)5]°.
Комплексные соединения могут относиться к кислотам (Н [АиС14]); основаниям ([Ag(NH3)2] ОН), солям (Na3 [AIF6]), неэлектролитам ([Pt(NH3)2Cb]0).
Лигандами выступают атомы, ионы, молекулы, имеющие неподе- ленные электронные пары: Н2О; NH3; СГ; Вг“; Г; F~; CN"; N02~; ОН ; СО0; остатки многоатомных спиртов, аминокислот; амины и т.д.
Учитель демонстрирует опыты: Получение комплексных соединений:
|
|
|
|
Номенклатура комплексных соединений
Сначала называют анион, потом катион, как бы читая формулу комплексного соединения с конца к началу.
В названиях комплексных соединений используют числительные: 2 - ди;3 - три;4 - тетра;5 - пента;6 - гекса;
названия лигандов: Н20- аква;NH3 - амин; СО - карбонил; ОН - гидроксо; F”; СГ; Br“; I - фторо-; хлоро-; бромо-; йодо-;CN - циано; N02~- нитрои т. д.
Если центральный ион входит в состав комплексного аниона, то анион называется:
Fe-феррат
Си - купрат
Ag - аргентат
Аи - аурат
Hg – меркурат
Zn - цинкат
А1 - алюминат и т. д.
После названия центрального иона в скобках указывается его валентность, равная заряду.
Если центральный ион входит в состав комплексного катиона, то он называется по-русски. Примеры:
К2+ [Hg+2I4]2- - тетрайодомеркурат (II) калия
[Си+2 (NH3)4о]2+ S042- - сульфат тетраамминмеди (II)
Feо(СО)5о - пентакарбонилжелезо (0).
Химические свойства комплексных соединений
1. Диссоциация [Си (NH3)4] S04^ [Си (NH3)4]2+ + S042'
Внутренняя сфера практически не диссоциирует.
2. Реакции по внешней сфере (учитель демонстрирует опыт). FeCl3 +К4 [Fe (CN)6] -► KFe [Fe(CN)6]l + ЗКС1
Синий
[Си (NH3)4]S04 +BaCI2 [Си (NH3)4] Cl2 +BaS04l
3. Реакции с участием лигандов: (демонстрация)
[Cu(NH3)4]S04 +4HCI -> 4NH4C1 + CuS04
4. Реакции по центральному иону: (демонстрация)
• Обменные: [Ag(NH3)2]Cl +KI -> Agll +КС1 +2NH3
желтый
• Окислительно-восстановительные:
|
|
Комплексообразование имеет большое значение для многих биологических процессов. В виде аквакомплексов находятся в крови, лимфе и тканевых жидкостях ионы щелочных и щелочноземельных металлов, выполняющих в организме важные и многообразные физиологические функции. Ионы d – элементов в результате высокой комплексообразующей способности находятся в организме исключительно в виде комплексов с белками и входят в состав гормонов, ферментов, витаминов и других жизненно важных соединений. Некоторые комплексные соединения обладают биологической активностью и применяются в качестве лекарственных препаратов - например витамин В12 , участвующий в процессах кроветворения, является комплексом кобальта.Токсические свойства некоторых веществ обусловлены их высокой комплексообразующей способностью. Например, токсическое действие на организм цианидов и оксида углерода объясняется их способностью образовывать прочные комплексы с катионами железа. Цианиды блокируют атомы железа, входящие в состав дыхательного фермента цитохромоксидазы, в результате прекращается клеточное дыхание. Оксид углерода (СО) связывает железо гемоглобина, вследствие этого гемоглобин утрачивает способность осуществлять транспорт кислорода. В медицинской практике при лечении многих заболеваний в качестве лекарственных препаратов используются соединения меди, серебра, цинка, кобальта, хрома, золота, платины, ртути и др.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|