
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Второй закон излучения Вина
1)Предмет теплотехника. Общие понятия и определения.— общетехническая дисциплина, изучающая методы получения, преобразования, передачи и использования теплоты, а также принцип действия и конструктивные особенности тепло- и парогенераторов тепловых машин, агрегатов и устройств. Теоретическими разделами теплотехники, в которых исследуются законы превращения и свойства тепловой энергии, а также процессы распространения теплоты являются техническая термодинамика и теория теплообмена.
2) Газовая смесь. Основные свойства газовых смесей. Газовой смесью понимается смесь отдельных газов, вступающих между собой ни в какие химические реакции. Каждый газ (компонент) в смеси независимо от других газов полностью сохраняет все свои свойства и ведет себя так, как если бы он один занимал весь объем смеси.
Множество нескольких различных газов, между которыми невозможно осуществить химическое взаимодействие, называют смесью идеальных газов. Давление рассчитывается по формуле:
Pi = NikT/ V,
где i= 1, 2, r, называется парциальным,
r– число газов в смеси;N – число молекул i-го газа;V– объем смеси;k– постоянная Больцмана;Т – температура.
Закон Дальтона отражает зависимость между давлением смеси идеальных газов и их парциальными давлениями. Он гласит: «Давление смеси rидеальных газов и сумма их парциальных давлений равны между собой». Математическая формулировка закона Дальтона выглядит следующим образом:
Р = Р1 + Р2 +… + Pr = NkT/ V,
где N = N1 + N2 +. + Nr – число молекул в смеси r газов.
Закон Амага. Он отражает зависимость между объемом смеси идеальныхгазов и их парциальными объемами. Закон Амага гласит: «Объем смеси rидеальных газов и сумма их парциальных объемов равны между собой»:
V=V1+V2+…+Vr.
Параметры газовой смеси можно найти, зная закон Клапейрона:
PV=mRT,
Отношение массы каждого газа к общей массе смеси называют массовой долей:
g1 = m1/ m; g2= m2/ m; …; gn = mn/ m,
где g1, g2, gn– массовые доли;
m1, m2, mn– массы газов по отдельности;
m– масса смеси.
Сумма массовых долей всех газов смеси равняется единице.
Масса смеси является суммой масс газов, входящих в эту смесь.
Отношение парциального объема к объему всей смеси называют объемной долей:
r1= V1/ V, r2= V2/ V,., rn = Vn/ V,
где r1, r2, rn– объемные доли;
V1, V2,., Vn– парциальные объемы газов смеси;
V– объем смеси газов.
3)Способы заданий газовых смесей.
Состав газовой смеси может быть задан массовыми, объемными или мольными долями. Массовой долей называется отношение массы отдельного компонента Gi к массе смеси G:
mi=Gi/G.
Очевидно, что
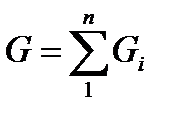 , откуда
, откуда 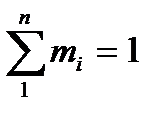 .
.
Массовые доли часто задаются в процентах. Например: для сухого воздуха 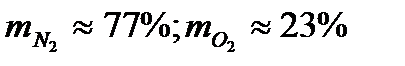 .
.
Объемная доля – представляет собой отношение приведенного объема газа Vi к полному объему смеси V:
ri=Vi/V
приведенным называется объем, который занимал бы компонент газа, если бы его давление и температура равнялись давлению и температуре смеси.
Согласно закону Дальтона имеем: 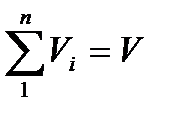 , откуда
, откуда 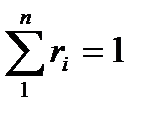 .
.
Объемные доли так же задаются в процентах.
Для воздуха: 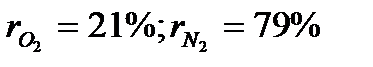 .
.
Мольной долей – называется отношение количества молей Ni рассматриваемого компонента к общему количеству молей смеси N.
Число молей смеси 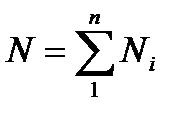 , а мольная доля компонента будет равна
, а мольная доля компонента будет равна 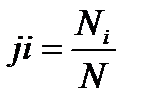 .
.
В соответствии с законом Авогадро объемы моля любого газа при одинаковых р и Т, в частности при температуре и давлении смеси, одинаковы. Поэтому приведенный объем любого компонента может быть вычислен как произведение объема моля Vm на число молей этого компонента, т.е. Vi=VmNi, а объем смеси – по формуле: V=VmN. Тогда Vi/V=ri=Ni/N и, следовательно, задание смеси идеальных газов мольными долями равнозначно заданию ее объемными долями.
Соотношение между массовыми и объемными долями. 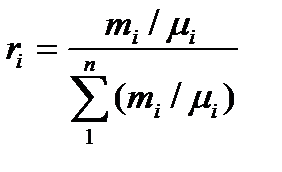 Уравнение состояния для смеси газов
Уравнение состояния для смеси газов
PVсм=GRсм T.
Газовая постоянная смеси.
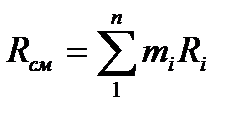 .Или, поскольку Ri=8314/mi, то газовая постоянная смеси [Дж/(кг×К)] имеет вид:
.Или, поскольку Ri=8314/mi, то газовая постоянная смеси [Дж/(кг×К)] имеет вид: 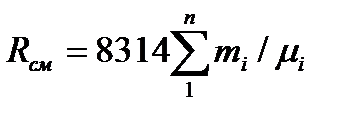 .
.
Средняя молекулярная масса смеси: 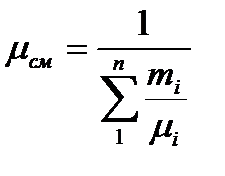
4) Определение парциальных объёмов газа.
Под парциальным объемом газа понимают объем, который занимал бы этот газ, если бы его температура и давление соответствовали температуре и давлению смесь.
5)Первый закон термодинамики.
(формулировка) Количество теплоты, полученное системой, идёт на изменение её внутренней энергии и совершение работы против внешних сил.
6) Второй закон термодинамики.
—физический принцип, накладывающий ограничение на направление процессов передачи тепла между телами. Существуют несколько эквивалентных формулировок второго начала термодинамики:
Постулат Клаузиуса: «Невозможен процесс, единственным результатом которого являлась бы передача тепла от более холодного тела к более горячему»[1] (такой процесс называется процессом Клаузиуса).
Постулат Томсона (Кельвина): «Невозможен круговой процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара» (такой процесс называется процессом Томсона).
7-8)Законы идеальных газов
8-7)Уравнение состояния идеальных газов.
Под идеальным газом понимается газ, в котором отсутствуют силы гравитационного взаимодействия между молекулами, образующими газ, а механическое взаимодействие молекул ограничено лишь упругим соударением, сами молекулы при этом представляют идеально упругие материальные точки, не имеющих объема.
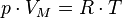 ,
,
где
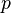 — давление,
— давление,
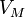 — молярный объём,
— молярный объём,
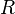 — универсальная газовая постоянная
— универсальная газовая постоянная
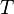 — абсолютная температура, К.
— абсолютная температура, К.
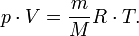
Эта форма записи носит имя уравнения (закона) Менделеева — Клапейрона.
T= const: p*v=const— закон Бойля -Мариотта.
P=const : V/T =const — Закон Гей-Люссака.
V=const : P/T=const —закон Шарля
А в форме пропорции этот закон удобен для расчёта перевода газа из одного состояния в другое.
(P1*V1)/T1=(P2*V2)/T2
9) Универсальное уравнение состояния идеальных газов.
Идеальным газом называется такой газ, у которого отсутствуют силы взаимного притяжения и отталкивания между молекулами и пренебрегают размерами молекул. Все реальные газы при высоких температурах и малых давлениях можно практически считать как идеальные газы.
РV=RТ,
где R - универсальная газовая постоянная.
10) Свойства реальных газов.
При повышении плотности изменяются свойства Газов, они перестают быть идеальными. Уравнение состояния оказывается неприменимым, т. к. средние расстояния между молекулами Газы становятся сравнимыми с радиусом межмолекулярного взаимодействия. Для описания термодинамических свойств неидеальных, или, как их чаще называют, реальных, Газы пользуются различными уравнениями состояния, имеющими более или менее строгое теоретическое обоснование. Простейшим примером уравнения, которое качественно правильно описывает основные отличия реального Газы от идеального, служит уравнение Ван-дер-Ваальса. Оно учитывает, с одной стороны, существование сил притяжения между молекулами (их действие приводит к уменьшению давления Газы), с другой стороны — сил отталкивания, препятствующих безграничному сжатию Газов.
11) Уравнение Ван-дер-Вальса.
Уравнение состояния
Термическим уравнением состояния (или, часто, просто уравнением состояния) называется связь междудавлением, объёмом и температурой.Для одного моля газа Ван-дер-Ваальса оно имеет вид: 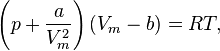 где
где
P— давление,Vm — молярный объём,
T — aбсолютная температура,R — универсальная газовая постоянная.Видно, что это уравнение фактически является уравнением состояния идеального газа с двумя поправками. Поправка 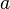 учитывает силы притяжения между молекулами (давление на стенку уменьшается, так как есть силы, втягивающие молекулы приграничного слоя внутрь), поправка
учитывает силы притяжения между молекулами (давление на стенку уменьшается, так как есть силы, втягивающие молекулы приграничного слоя внутрь), поправка 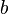 — объем молекул газа.Для
— объем молекул газа.Для 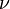 молей газа Ван-дер-Ваальса уравнение состояния выглядит так:
молей газа Ван-дер-Ваальса уравнение состояния выглядит так: 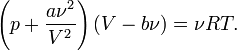 гдеV— объём,
гдеV— объём,
12-13) Теплоёмкость газов.
13-12) Массовая, объёмная и мольная теплоёмкость газа.
Теплоемкостью называют количество тепла, которое необходимо сообщить телу (газу), чтобы повысить температуру его количественной единицы на 10С или: с=dQ/dT.
Теплоемкость относят к единице количества вещества и различают:
- удельную массовую теплоемкость с, отнесенную к 1 кг газа, Дж/(кгК)
- удельную объемную теплоемкость с1, отнесенную к количеству газа, содержащегося в 1 м3 объема при нормальных условиях, Дж/(м3К);
- удельную мольную теплоемкость mс, отнесенную к одному киломолю, Дж/(кмольК).
Зависимость между удельными теплоемкостями устанавливается соотношениями:
с=mс/m; c1=crн
rн – плотность газа при нормальных условиях.
Изменение температуры тела при одном и том же количестве сообщаемой теплоты зависит от характера происходящего при этом процесса, поэтому теплоемкость является функцией процесса. Это означает, что одно и то же рабочее тело в зависимости от процесса требует для своего нагревания на 1 градус различного количества теплоты. Численно величина с изменяется от +¥ до -¥.
В термодинамических расчетах большое значение имеют:
теплоемкость при постоянном давлении (изобарный процесс):
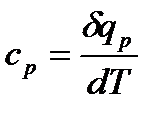
равна отношению количества теплоты, сообщенного телу в процессе при постоянном давлении, к изменению температуры тела.
теплоемкость при постоянном объеме (изохорный процесс):
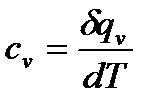
она равна отношению количества теплоты, подведенного к телу в процессе при постоянном объеме, к изменению температуры тела.
Между теплоемкостями при постоянном объеме и при постоянном давлении существует связь (уравнение Майера):
ср=сv+R.
Это уравнение является одним из основных в технической термодинамике.
В процессе v=const теплота, сообщаемая газу, идет лишь на изменение его внутренней энергии, а в процессе при p=const теплота расходуется и на увеличение внутренней энергии и на совершение работы против внешних сил. Поэтому ср больше сv на величину этой работы.
14)Средняя и истинная теплоёмкость. Под средней теплоемкостью понимают отношение количества теплоты q, подведенной к единице количества вещества (газа), к изменению его температуры от t1 до t2 при условии, что разность температур t2 – t1 является величиной конечной.
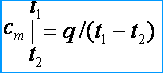 Под истинной теплоемкостью понимают теплоемкость газа, соответствующую бесконечно малому изменению температуры газа, соответствующую бесконечно малому изменению температуры dt, т. е.c = dq/dt,
Под истинной теплоемкостью понимают теплоемкость газа, соответствующую бесконечно малому изменению температуры газа, соответствующую бесконечно малому изменению температуры dt, т. е.c = dq/dt,
15)Влажный воздух.Основные понятия и определения.
Смесь сухого воздуха и водяного пара наз. Влажный воздух. Смесь сост. из сухого возд. и насыщ. пара наз. нысыщ. влажный воздух.Абсолютной влажностью воздуха называют отношение массы водяного пара, содержащегося во влажном воздухе, к его объему: 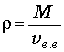
16)Водяной пар. Основные понятия и определения.
газообразное состояние воды.Переход
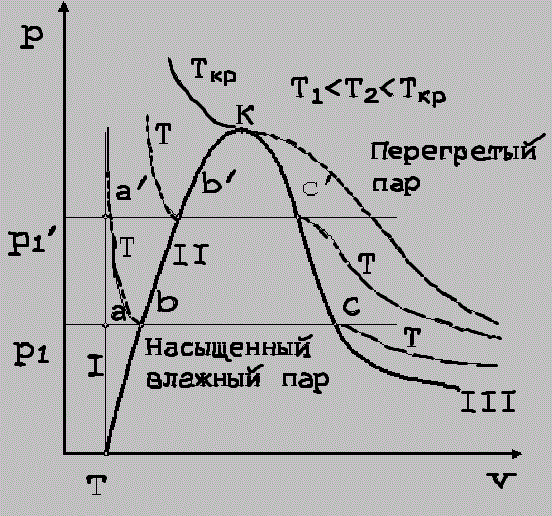
вещества из твердого состояния в жидкое называется плавлением, из жидкого в газообразное — испарением, из твердого в газообразное — сублимацией. Обратные процессы соответственно называются затвердеванием,или кристаллизацией, конденсацией и десублимацией.Испарением называется парообразование, происходящее только со свободной поверхности жидкости и при любой температуре. Кипением называется бурное парообразование по всей массе жидкости, которое происходит при сообщении жидкости через стенку сосуда определенного количества теплоты. Насыщенным паром называют пар, который образовался в процессе кипения и находится в динамическом равновесии с жидкостью. Сухой насыщенный пар представляет собой пар, не содержащий капель жидкости и имеющий температуру насыщения (t=tн) при данном давлении.Влажный насыщенный пар – это равновесная смесь, состоящая из капель жидкости, находящейся при температуре кипения, и сухого насыщенного пара. Пар, температура которого при данном давлении больше, чем температура насыщения (t>tн), называется перегретым.
17) PV -диаграмма водяного пара
18)Теплопроводность. Основные понятия и определения. Теплопрово́дность — это процесс переноса внутренней энергии от более нагретых частей тела (или тел) к менее нагретым частям (или телам). Изотопным наз. тело облад. одинак-ми физ. св-ми по всем направлениям.Температурным полем наз. совокупность темпер-р во всех т. тела или пространства в данный момент времени. Стацион. температурным полем наз. темпер. не изм. во времени.
19)Закон Фурье. Коэффициент теплопроводности.
Закон Фурье- кол-во тепла проходящие через элемент изотермической поверхности за промежуток времени пропорционально температурному градиенту. Коэф. теплопроводн. характериз. способность вещ-ва проводить тепло.
20)Дифференциальное уравнение теплопроводности.
— важное уравнение в частных производных, которое описывает распространение тепла в заданной области пространства во времени.
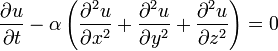
21)Передача теплоты теплопроводностью через однослойную плоскую стенку.
22) Передача теплоты теплопроводностью через многослойную плоскую стенку.
23)Передачи теплоты теплопроводностью через однослойную цилиндрическую стенку.
Рассмотрим однородную цилиндрическую стенку длиной l с внутренним радиусом r1 и наружным радиусом r2 (рис. 18). Будем считать, что коэффициент теплопроводности материала стенки постоянен и равен l. Внутренняя и наружная поверхности имеют температуры соответственно t1 и t2, причем t1>t2. Температура является функцией одного только текущего радиуса, поэтому изотермические поверхности в данном случае будут цилиндрическими, имеющими с цилиндрической стенкой общую ось.
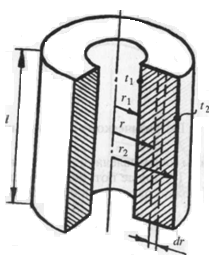
Рис. 18
Выделим на некотором расстоянии r от оси цилиндра слой толщиной dr. Согласно закону Фурье количество теплоты проходящей через слой, равно 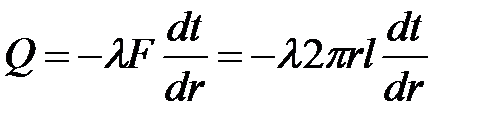 . (4.11)
. (4.11)
Введем в рассмотрение понятие погонной плотности теплового потока, т.е. теплового потока, приходящегося на единицу длины стенки (qпог, Вт/м2)
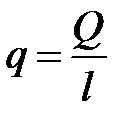 .
.
Подставим в это выражение величину Q (4.11)
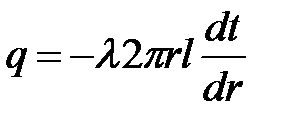 .
.
Разделив переменные и проинтегрировав, получим
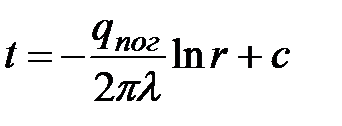 .
.
Как известно, при r=r1 t= t1, а при r=r2 t= t2.
Тогда
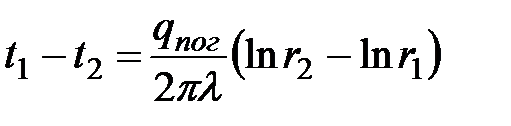 .Отсюда
.Отсюда
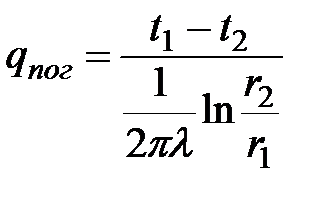 .
.
По физическому смыслу выражение 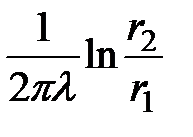 является тепловым сопротивлением трубы, отнесенным к одному погонному метру.
является тепловым сопротивлением трубы, отнесенным к одному погонному метру.
Тепловые потери через всю цилиндрическую стенку длиной l можно рассчитать по формуле 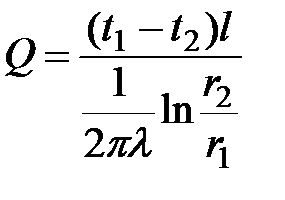 .
.
24)Передача теплоты теплопроводности через многослойную цилиндрическую стенку.
В случае многослойной цилиндрической стенки размеры каждого из слоев задают соответствующими радиусами, и толщина может быть определена как разность внешнего и внутреннего радиусов, т.е.
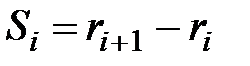 .
.
Рассмотрим цилиндрическую стенку, состоящую из трех слоев, выполненных из различных материалов с коэффициентами теплопроводности l1, l2, l3 (рис. 19). Температуры внутренней и наружной поверхностей известны и равны соответственно t1 и t4, а вот значения температур между слоями неизвестны. Обозначим их через t2 и t3.
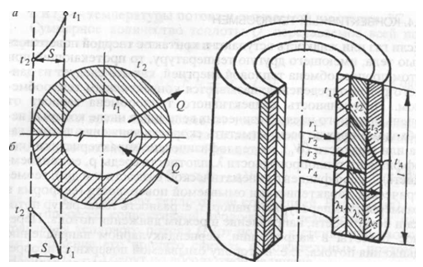
Рис. 19
Используя величину qпог, можно легко вывести формулу для расчета тепловых потерь данной стенки
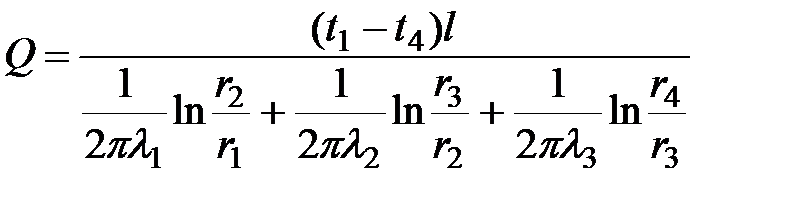 .
.
В общем виде для цилиндрической стенки, имеющей n слоев, формула примет вид
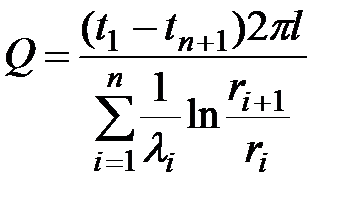 .Температуру между слоями, число которых равно n, можно рассчитать по формуле
.Температуру между слоями, число которых равно n, можно рассчитать по формуле
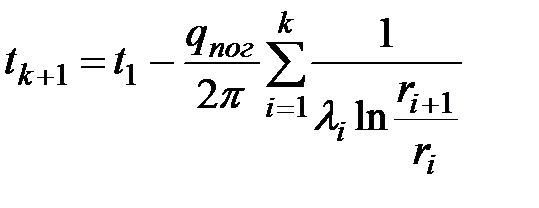 ,где k – номер слоя, за которым мы определяем искомую температуру.
,где k – номер слоя, за которым мы определяем искомую температуру.
25)Теплообмен излучением. Законы излучения абсолютно черного тела.
Тепловое излучение представляет собой процесс распространения в пространстве внутренней энергии излучающего тела путём электромагнитных волн Законы излучения абсолютно чёрного тела: Первый закон излучения Вина
· 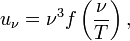
где uν — плотность энергии излучения,
ν — частота излучения,
T — температура излучающего тела,
f — функция, зависящая только от частоты и температуры.
Второй закон излучения Вина
В 1896 году Вин, на основе дополнительных предположений, вывел второй закон: 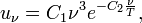
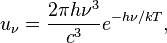
где h — постоянная Планка,
k — постоянная Больцмана,
c — скорость света в вакууме.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|