
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Термодинамические циклы
1) Термодинамическая система – совокупность микроскопических тел, которые являются предметом изучения и находятся во взаимодействии с окружающими телами.
Способы передачи энергии: Передача теплоты, совершение механической работы и обмен\изменение\передача массы.
Классификация термодинамических систем:
- По возможности обмена энергии с окружающей средой:
*Закрытая(не обмениваются);
*Открытая (обмениваются);
*Изолированная (не может обмениваться);
*Неизолированная (может обмениваться);
*Полуизолированная (обменивается только теплотой или только работой);
*Теплоизолированная или адиабатная (может обмениваться только работой).
- По однородности:
*Однородная система;
*Неоднородная система.
Изобарный процесс - термодинамический процесс, при котором P – const.
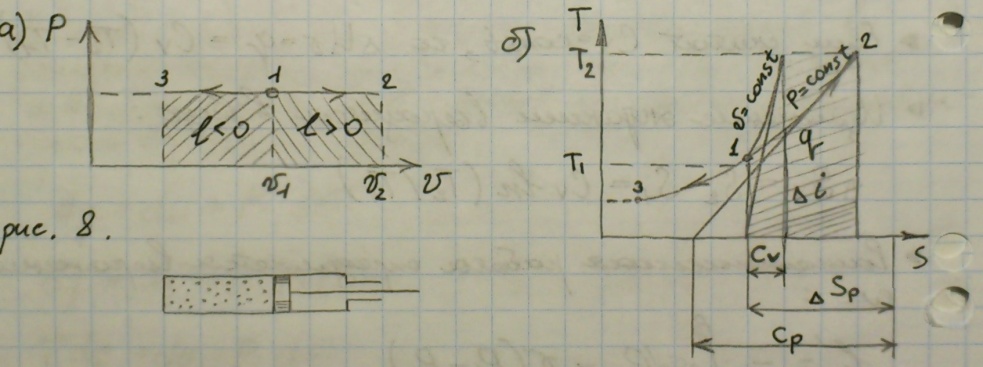
1 закон термодинамики для данного процесса: q = CP(T2 – T1) = i2-i1.
Работа: L = R(T2 – T1).
Изменение энтропии: ΔSp = Cpln(T2\T1).
V\T = R\P = const. V2\V1 = T2\T1.
2) Термодинамические параметры состояния – совокупность нескольких макроскопических величин, которые определяют физическое состояние термодинамических систем. Термодинамические параметры бывают: Основные (Определяют состояние системы, например P,T,V) и калорические (удельная внутренняя энергия (u), Этропия (s), энтальния(i)); Интенсивные (не зависят от массы, например температура) и Экстенсивные (пропорциональны массе, например удельный объем); Зависимые и независимые (все термодинамические параметры являются независимыми, остальные зависимые и могут быть выражены через независимые); Внешние (определяют состояние окружающей среды) и внутренние параметры (определяют состояние термодинамической системы).
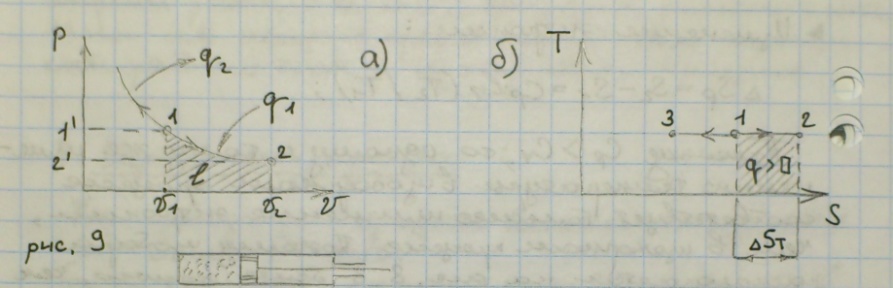
Изотермический процесс – термодинамический процесс, при котором T – const.
PV = RT,
P2\P1 = V1\V2.
ΔU = 0,
ΔS = 0,
1 закон термодинамики для процесса.
q = l = RTln(V2\V1) = P1V1ln(P1\P2)
Изменение энтропии Rln(P1\P2).
3) Равновесная система – система, в которой во всех точках ее объема давление, температура, удельный объем и другие физические свойства одинаковые. Неравновесная система – система, в которой хотя бы 1 физический параметр не имеет постоянного значения во всех единицах объема. Общее уравнение состояния: f(V,P,T) = 0.
Нулевое начало термодинамики (общее начало термодинамики) — физический принцип, утверждающий, что вне зависимости от начального состояния системы в конце концов в ней при фиксированных внешних условиях установится термодинамическое равновесие, а также что все части системы при достижении термодинамического равновесия будут иметь одинаковую температуру.
4) Идеальный газ - газ, который полностью подчиняется газовым законом. Свойства: полностью отсутствует сила взаимодействия между молекулами, размерами молекул можно пренебречь и принять их за материальные точки.
PV = mRT.
Универсальная газовая постоянная – численно равна работе расширения одного моля идеального газа при увеличении температуры на 1 К (R = 8,31 Дж⁄(моль∙К)).
Удельная газовая постоянная – газовая постоянная, отнесенная к единице массы. (R = 287 Дж⁄(кг∙К)).
5) Газовые смеси – смесь нескольких газов, не вступающих в реакцию. Парциальное давление – давление, которое имел бы газ, если бы находился один в том же количестве, притом же давлении и температуре, что и в смеси.
Уравнение Дальтона:
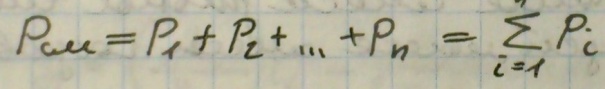
Газовая смесь может быть задана массовыми(Отношение массы i-того компонента к массе смеси, gi = mi\mсм), мольными(отношение количества вещества компонента к общему количеству вещества смеси, , ri = vi\vсм, аналогично заданию смеси объемными долями) и объемными долями (Отношение парциального объема газа к общему объему смеси, ri = vi\vсм) .
6) 1 закон термодинамики – количество теплоты, подведенной к системе, расходуется на изменение внутренней энергии и совершение работы (Q = ΔU+L, dq = du+dl = du+pdv).
Работа процесса – передача внутренней энергии от одного тела к другому, связанная с изменением его объема рабочего тела, перемещением его во внешнем пространстве или изменением его положения. Виды: Работа по изменению объема (L = P*ΔV, dL = PdV. Любая работа графически эквивалентна площади процесса на P-V диаграмме.), Работа вытеснения (работа, которую нужно совершить, чтобы разместить газ объемом V в среде с давлением P, L = ΔP*V, dL = VdP), Полезная\располагаемая работа (разность работы по изменению объема и работы вытеснения, L' = L – Lвыт, dl’ = dl - dlвыт), работа без изменения объема (L' = L – Lвыт+LΔV, dl’ = dl - dlвыт+dlΔv.).
7) 1 закон термодинамики – количество теплоты, подведенной к системе, расходуется на изменение внутренней энергии и совершение работы (Q = ΔU+L, dq = du+dl = du+pdv).
Внутренняя энергия – сумма кинетической и потенциальной энергий.
Свойства: 1) при 0 0С равна 0; 2) Полная внутренняя энергия параметр экстенсивный, пропорционален массе; 3) Удельная внутренняя энергия – внутренняя энергия, отнесенная к единице массы; 4)Удельная внутренняя энергия сложной термодинамической системы равна сумме удельных энергий каждого компонента; 5) Термодинамическая система в каждом своем состоянии может иметь только одно значение внутренней энергии; 6) Внутренняя энергия зависит только от начального и конечного состояния системы; 7)Изменение внутренней энергии в круговом процессе равна 0; 8) Если температура термодинамической системы возрастает, то изменение внутренней энергии будет возрастать, если убывает – будет убывать.
Энтальпия – теоретическая величина, позволяющая упростить расчет термодинамической системы. (i = U +PV, dq = di + vdp). Свойства: 1)является функцией состояния(зависит от параметров состояния); 2) Экстенсивная функция; 3) Удельная энтальпия – интенсивный параметр; 4) изменение энтальпии в круговом процессе равно 0; 5) физический смысл энтальпии определяют как энергию расширенной системы: Тело + окружающая среда.
8) Теплоемкость – отношение элементарного количества теплоты, полученное телом при бесконечно малом изменении его состояния к изменению температуры в данном процессе.(C = dq\dT). Виды: 1)Полная (количество теплоты, которое нужно подвести к телу массой m и объемом V, чтобы изменить температуру на 1К.); 2)Удельная (Полная, отнесенная к единице объема, массы, количеству вещества(мольная) ); 3) Изобарная (СР) и изохорная (СV); 4) Истинная (при данной температуре или данной точке); 5) Средняя (теплоемкость в данном интервале температур.)
Уравнение Майера для идеальных газов СP – CV = R, для реальных СP – CV > R.
9) Энтропия – теоретический параметр и зависит только от количества подведенной теплоты. Нельзя измерить. Определяется ds = dq\T.
S-T –диаграмма представляет собой зависимость температуры от энтропии.
Свойства: 1)количество подводимой или отводимой теплоты эквивалентно площади под процессом; 2) теплота, которая выделяется или расходуется эквивалентна площади внутри цикла; 3)Длинная проекции касательной эквивалента удельной теплоемкости в точке касания.
10) Изохорный процесс – процесс, протекающий при постоянном объеме.
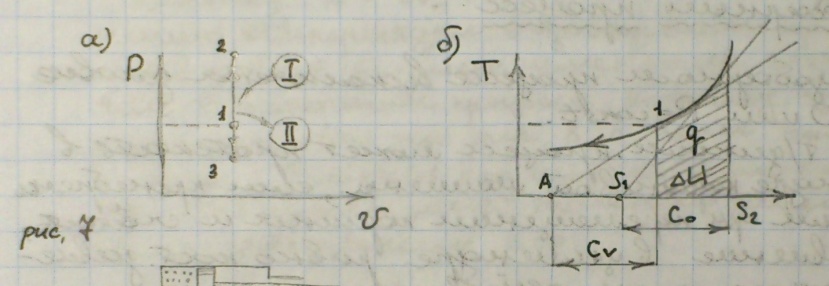
P\V = R\T;
P2\P1 = T2\T1;
dq = Tds = du + dl = Cvdt + Pdv;
Если считать, что Cv – const, то ΔUv = q = Cv(T2 – T1);
Изменение энтропии ΔSv = S2 – S1 = Cvln(T2 – T1);
Располагаемая работа l' = V(P1 – P2).
11) Адиабатный процесс – процесс, протекающий без взаимодействия с окружающей средой, т.е. при q = 0.
du + Pdv = 0;
Показатель адиабаты: K = CP \ CV;
C учетом уравнения Майерса r = CP – Cv;
K = 1+ R\Cv, отсюда следует, что СV = R\(K-1);
Уравнение адиабаты: PVK – const;
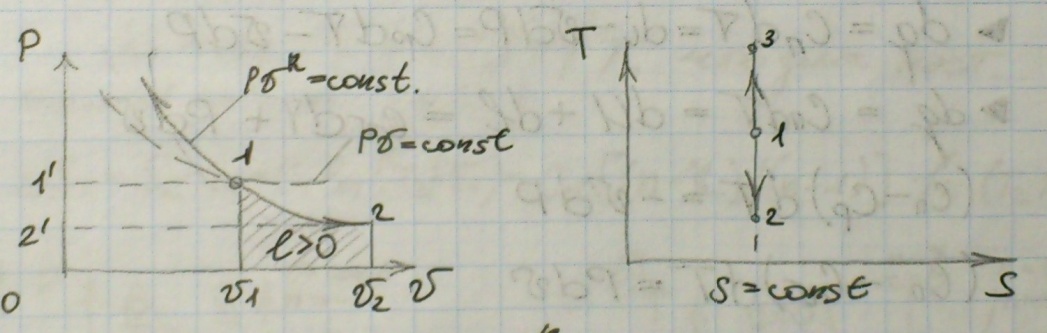
P2\P1 = (V1\V2)K;
T2\T1 = (V1\V2)k-1 = (P2\P1)(k-1)\k;
Располагаемая работа: l’ = kl;
Работа цикла: l = Cv(T1 – T2) = (P1V1 – P2V2)\K-1;
C = 0.
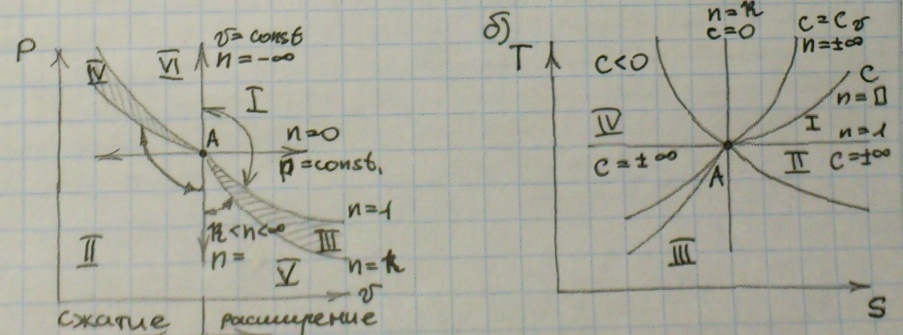
12) Политропный процесс – процесс при постоянной теплоемкости, т.е C – const.
PVn – const;
dq = CpdT – VdP;
dq = CVdT – PdV;
(Cn - Cp)dT = -VdP;
(Cn - Cv)dT = PdV;
Удельная теплоемкость: Cn = Cv[(n-k)\(n-1)];
Внешняя работа: l = [1\(1-n)]\(P1V1 – P2V2);
Располагаемая работа: l’ = [n\(n-1)]*R(T1-T2);
Изменение энтропии: ΔS = Cv[(n-k)\(n-1)]*ln(T2 – T1);
13) Второй закон термодинамики : Теплота самопроизвольно может передаваться от более нагретого тела к менее нагретому, вечный двигатель 2 рода невозможен (все теплота преобразуется в работу или наоборот).
Обратимы процесс: процесс, в котором система в прямом и обратном направлениях проходит через одни и те же состояния, причем не должно оставаться каких либо остаточных изменений.
Необратимы процесс: процесс, в котором система в прямом и обратном направлениях не может пройти через одни и те же состояния.
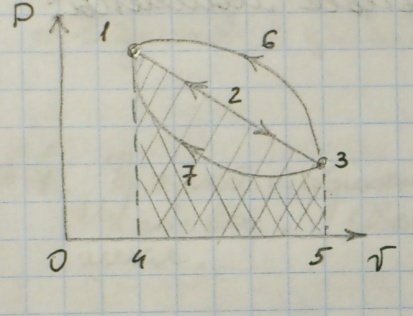
Термодинамические циклы
Существуют 3 основных типа циклов:
1) 1-2-3-2-1, Lц = lрасш – lсж, стремится к 0.
2) 1-2-3-7-1, Lц > 0.
3) 1-2-3-6-1, Lц <0. (Обратный цикл, пример: холодильная машина).
14) Термодинамический кпд – оценивет эффективность прямого цикла, отношение полезнозатраченной теплоты ко всему количеству теплоты: ηt = |qц|\|q1| = |lц|\|q1| = [|q1| - |q2|]\|q1| = 1 - |q2|\|q1|.
Холодильный коэффициент: оценивает эффективность холодильных машин, отношение отведенного количества теплоты к работе, затраченной на отведение этого кколиччества теплоты: |q2|\[|q1| - |q2|].
Примой и обратный цциклы карно:
Идеальный термодинамический цикл. Тепловая машина Карно, работающая по этому циклу, обладает максимальным КПД из всех машин, у которых максимальная и минимальная температуры осуществляемого цикла совпадают соответственно с максимальной и минимальной температурами цикла Карно. 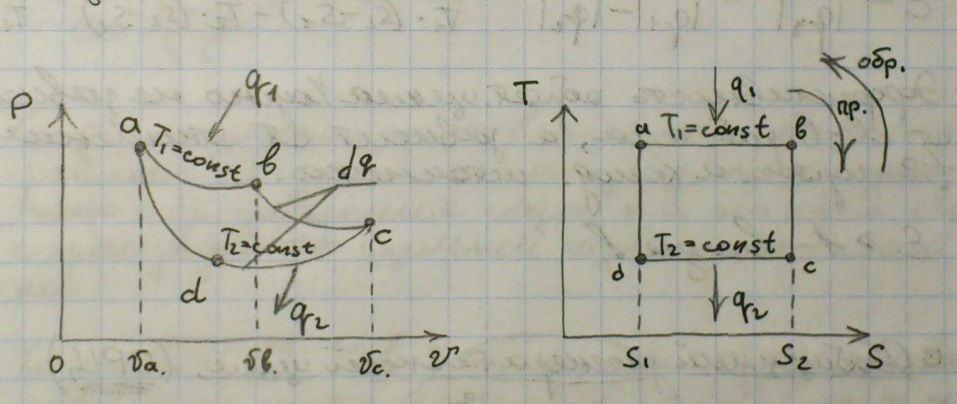
Свойства:
1) Эффективность прямого и обратного цикла не зависит от свойств рабочего тела, определяется отношением температур горячего и холодного источника. E = T2\(T1 – T2);
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|