
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Газовые смеси и теплоемкости
Газовые смеси и теплоемкости
Газовая смесь задана следующим образом: в вариантах с № 1 по 15 в объемных долях ri, с № 16 по 30 в массовых gi долях, процентным составом компонентов смеси (графа 1); давление смеси pсм = …[бар] (графа 2), объем смеси Vсм = …[м3] (графа 3), температура смеси tсм=100C (Tсм=373 K).
Определить:
- состав смеси (если состав смеси задан в объемных долях, то представить его в массовых долях, если состав смеси задан в массовых долях, то представить его в объемных долях);
- газовые постоянные компонентов и смеси, [кДж/(кг•К)].
- среднюю молярную массу смеси, [кг/кмоль], выраженную через объемные и массовые доли;
- парциальные давления компонентов pi, выраженные через объемные ri и массовые gi доли;
- массу смеси mсм, [кг] и ее компонентов mi, [кг]; - парциальные объемы Vi, [м3] и плотности ρi, [кг/м3] компонентов и смеси ρсм, [кг/м3];
- истинную молярную, [кДж/(кмоль•К)], объемную, [кДж/(м3•К)] и массовую, [кДж/(кг•К)] теплоемкости, при температуре смеси t, [C] (графа 4).
- среднюю молярную, [кДж/(кмоль•К)], объемную, [кДж/(м3•К)] и массовую, [кДж/(кг•К)] теплоемкости интервала температур t1–t2, [C] (графа 5).
- количество теплоты Q, [кДж], необходимое для нагрева (охлаждения), на интервале температур t1–t2, [C] (графа 5) для случаев, когда количество вещества смеси задано как: 2 моль, 5 м3, 7 кг.
Таблица 1
| № задачи | |||||||||||||||
| CO2 | H2 | CO | N2 | H2O | SO2 | O2 | |||||||||
| - | - | - | 0.95 | 200-1000 | 29.66 | ||||||||||
| - | - | - | 1.0 | 300-100 | 29.92 | ||||||||||
| - | - | - | 0.9 | 100-30 | 25.7 | ||||||||||
| - | - | - | 1.05 | 600-200 | 29.72 | ||||||||||
| - | - | - | 1.05 | 1000-100 | 24.4 | ||||||||||
| - | - | - | 0.85 | 900-200 | 21.0 | ||||||||||
| - | - | - | 0.7 | 700-500 | 29.9 | ||||||||||
| - | - | - | - | 0.95 | 500-200 | 29.7 | |||||||||
| - | - | - | 1.0 | 800-300 | 30.7 | ||||||||||
| - | - | - | 1.05 | 600-100 | 30.2 | ||||||||||
| - | - | - | 1.15 | 750-250 | 31.9 | ||||||||||
| - | - | - | 1.2 | 1000-500 | 30.35 | ||||||||||
| - | - | - | 1.25 | 300-1300 | 27.92 | ||||||||||
| - | - | - | 1.05 | 600-900 | 30.1 | ||||||||||
| - | - | - | 0.85 | 1000-400 | 23.6 | ||||||||||
| - | - | - | 1.2 | 850-350 | 33.16 | ||||||||||
| - | - | - | 1.0 | 350-750 | 9.33 | ||||||||||
| - | - | - | 0.9 | 900-600 | 28.65 | ||||||||||
| - | - | - | 1.0 | 450-300 | 23.04 | ||||||||||
| - | - | - | 1.05 | 300-150 | 12.67 | ||||||||||
| - | - | - | 1.05 | 800-300 | 28.61 | ||||||||||
| - | - | - | 1.0 | 400-300 | 17.04 | ||||||||||
| - | - | - | 0.95 | 800-300 | 29.14 | ||||||||||
| - | - | - | 1.15 | 650-150 | 12.37 | ||||||||||
| - | - | - | 0.85 | 150-1200 | 23.82 | ||||||||||
| - | - | - | 1.0 | 300-800 | 29.61 | ||||||||||
| - | - | - | 1.0 | 1200-1000 | 9.21 | ||||||||||
| - | - | - | 0.9 | 400-900 | 28.78 | ||||||||||
| - | - | - | 0.95 | 800-600 | 14.32 | ||||||||||
| - | - | - | 1.0 | 600-100 | 28.42 | ||||||||||
Пример решения задачи №1. Смесь имеет следующий объёмный состав:
| CO2=12% | r CO2 =0.12 |
| Na=75% | r Na=0.75 |
| H2O=8% | r H2O=0.08 |
| O2=5% | r O2=0.05 |
| Всего:100% | ∑ri=1.0 |
Объём смеси Vсм=3м3;давление смеси рсм=1 бар(105Н/м2); температура смеси tсм=1000С(Тсм=373К). температура при которой определяется истинная теплоёмкость смеси, t=20000С(Т=2273К),интервал температур, для которого определяется средняя теплоёмкость смеси : t1=2000C(Т1=473К); t2=10000C(Т2=1273К).
Решение. Состав смеси в массовых долях:
gi=riμ/(∑riμi); (1)
gCO2= 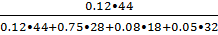 =
= 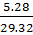 =0.18;
=0.18;
g N2=0.75•28/29.32=0.716;
g H2O=0.08•18/29.32=0.049;
g O2=0.05•32/29.32=0.055;
∑gi=1.000
Газовые постоянные компонентов смеси [кДж/(кг•К)];
Ri=8.34/μi; (2)
RCO2=8.34/44=0.189;
RH2O=8.34/18=0.462;
R N2=8.34/28=0.297;
R O2=8.34/32=0.260;
Газовая постоянная смеси
Rсм=∑giRi=0.18•0.189+0.716•0.297+0.049•0.462+0.055•0.260=0.284 кДж/(кг•К)
Средняя молярная масса смеси:
а) через объёмные доли
μсм=∑riμi=0,12•44+0,75•28+0,08•18+0,05•32=29,32 кг/моль
(проверка μсм=8,314/Rсм=8.314/0.284=29.32)
б) через массовые доли
μсм=1/∑(gi /μi)=1/( 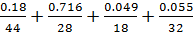 )=1/0.03413=29.32 кг/моль.
)=1/0.03413=29.32 кг/моль.
Парциальное давление компонентов смеси:
а) через объёмные доли
pi=pсмri; (3)
pCO2=1.0•0.12=0.12 бар;
pN2=1.0•0.75=0.75 бар;
pH2O=1.0•0.08=0.08 бар;
pO2=1.0•0.05=0.05 бар;
∑ pi=pсм=1.0 бар;
б) через массовые доли
pi=pсмgRi/Rсм (4)
pCO2=1.0•0.18•0.189/0.284=0.12 бар;
pN2=1.0•0.716•0.297/0.284=0.75 бар;
pH2O=1.0•0.049•0.462/0.284=0.08 бар;
pO2=1.0•0.055•0.260/0.284=0.05 бар;
∑ pi=pсм=1.0 бар.
Масса смеси
Mсм=pсмVсм/(RсмTсм)=1.0•105•3/(0.284•103•373)=2.83 кг
Массы компонентов:
mi= mсмgi; (5)
mCO2= 2.83•0.18=0.51 кг;
mN2= 2.83•0.715=2.025 кг ;
mH2O= 2.83•0.049=0.139 кг;
mO2= 2.83•0.055=0.156 кг;
∑ mi= mсм=2.83 кг.
Парциальные объёмы компонентов спеси:
Vi=riVсм(при pсм и Тсм); (6)
VCO2= 0.12•3=0,36 м3;
VN2= 0.75•3=2,25 м3 ;
VH2O= 0.08•3=0,24 м3;
VO2= 0.05•3=0,15 м3;
∑ Vi= Vсм=3.00 м3.
Истинная теплоёмкость смеси (при t=20000С):
а) молярная
μсрсм=∑ri (7) μсрсм=0.12•66.6628+0.75•36.1958+0.08•52.9371+0.05•38.4110=37.1кДж/(кмоль•К);
μсv= μсp-8.314 кДж/(кмоль•К);
μсv= 37.1-8.314=28.786 кДж/(кмоль•К);
б) объёмная
с*рсм= μсPсм/22,4=37,1/22,4=1,67 кДж/(м3•К);
с*рсм= μсVсм/22,4=28.786/22,4=1,28 кДж/(м3•К);
в) массовая
срсм= μсPсм/μсм=37,1/29,32=1,27 кДж/(кг•К);
срсм= μсVсм/μсм=28.786/22.4=0.98 кДж/(кг•К).
Средняя теплоёмкость смеси:
а) молярная
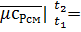 (μсPсм|
(μсPсм| 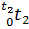 - μсPсм|
- μсPсм| 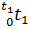 )/(t2-t1), где μсPсм|
)/(t2-t1), где μсPсм| 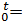 ∑μсPi|
∑μсPi| 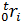 ;
;
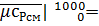 0.12•49.3987+31.2003+0.08•38.6245+0.05•33.1223=34.07 кДж/(кмоль•К);
0.12•49.3987+31.2003+0.08•38.6245+0.05•33.1223=34.07 кДж/(кмоль•К);
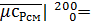 0.12•40.0650+0.75•29.1359+0.08•34.1251+0.05•29.9357=30.886 кДж/(кмоль•К);
0.12•40.0650+0.75•29.1359+0.08•34.1251+0.05•29.9357=30.886 кДж/(кмоль•К);
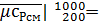 34.07•1000-30.886•200/(1000-200)=34.87 кДж/(кмоль•К);
34.07•1000-30.886•200/(1000-200)=34.87 кДж/(кмоль•К);
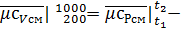 8.314=34.87-8.314=26.556 кДж/(кмоль•К);
8.314=34.87-8.314=26.556 кДж/(кмоль•К);
б) объёмная
с*рсм 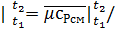 22.4=34.87/22.4=1.556 кДж/(км3•К);
22.4=34.87/22.4=1.556 кДж/(км3•К);
с*рсм 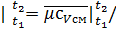 22.4=26.556/22.4=1.185 кДж/(км3•К);
22.4=26.556/22.4=1.185 кДж/(км3•К);
в) массовая
срсм 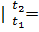 μсPсм
μсPсм 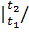 μсм=34.87/29.32=1.189 кДж/(кг•К);
μсм=34.87/29.32=1.189 кДж/(кг•К);
срсм 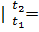 μсVсм
μсVсм 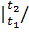 μсм=26.556/29.32=0.906 кДж/(кг•К);
μсм=26.556/29.32=0.906 кДж/(кг•К);
Примечание. Средние молярные теплоёмкости берутся из таблиц для температур t1=2000C и t2=10000C.
Количество теплоты необходимое на нагревание:
а) 2 кмоль смеси
Q`=μсрсм 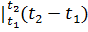 =2•34.87(1000-200)=55800 кДж;
=2•34.87(1000-200)=55800 кДж;
б) 5м3 смеси
Q``=5 с*рсм 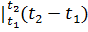 =5•1.556(1000-200)=62300 кДж;
=5•1.556(1000-200)=62300 кДж;
в) 7 кг смеси
Q```=7 срсм 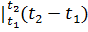 =7•1.189(1000-200)=6660 кДж
=7•1.189(1000-200)=6660 кДж
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|