
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Методика выполнения работы.
Химическое равновесие.
В равновесном состоянии химической реакции продукты реакции сосуществуют с не прореагировавшими исходными веществами. Соотношение между концентрациями продуктов реакции и исходных веществ является константой равновесия реакции Кс. Константа равновесия зависит от температуры и не зависит от концентрации участников реакции. Температурная зависимость константы равновесия реакции, протекающей при постоянном объеме, выражается уравнением изохоры Вант-Гоффа: 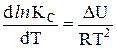 .
.
В небольшом интервале температур тепловой эффект реакции ΔU можно считать постоянным и после интегрирования вычислить его, зная константы равновесия при двух температурах
 . (32)
. (32)
Работа 9. Определение константы равновесия гомогенной реакции.
Целью работы является определение константы равновесия гомоген-ной реакции окисления йодида хлорным железом, которая протекает в водном растворе:
2 FeCl3 + 2 MeJ = J2 + 2 FeCl2 + 2 MeCl . (33)
Здесь символом МеJ обозначают один из йодидов щелочных металлов или аммония: KJ, NaJ, LiJ, NH4J; а символом MeCl – соответственно один из хлоридов: KCl, NaCl, LiCl или NH4Cl.
Поскольку реакция протекает при постоянном объеме, то константу равновесия представляют через концентрации
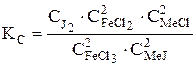 . (34)
. (34)
Экспериментально находят равновесную концентрацию йода путем титрования пробы реакционной смеси раствором тиосульфата натрия в присутствии крахмала и выражают равновесные концентрации всех участников реакции через концентрацию йода:
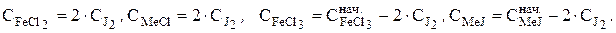 Следовательно, константа равновесия реакции КС принимает вид
Следовательно, константа равновесия реакции КС принимает вид
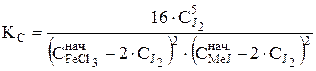 . (35)
. (35)
Таким образом, работа сводится к титрованию проб реакционной смеси раствором тиосульфата, определению равновесной концентрации йода и расчету константы равновесия реакции. Момент достижения равновесия фиксируется по установлению постоянных значений объемов тиосульфата, расходуемых на титрование проб реакционной смеси.
Исходными веществами служат растворы йодида 0,1 моль/л и хлор-ного железа 0,05 моль/л. Для ускорения достижения равновесного состоя-ния в реакционную смесь вводят некоторое количество раствора соляной кислоты 0,2 моль/л (катализатор). Для сохранения постоянства объема реакционной смеси при варьировании объемов реагентов используется разбавление смесей дистиллированной водой.
Необходимое оборудование: 2 колбы на 250 мл, пипетка на 2 мл, мензурки на 100 и 25 мл, бюретка на 50 мл (для тиосульфата натрия).
Необходимые реактивы: хлорное железо 0,05 моль/л, соляная кисло-та 0,2 моль/л, йодид калия (или натрия, лития, аммония) 0,1 моль/л, тиосульфат натрия 0,004 моль/л.
Методика выполнения работы.
В колбу на 250 мл с помощью мензурки на 100 мл наливают определенные объемы хлорного железа, соляной кислоты и воды (варианты заданий приводятся в таблице 2). С помощью мензурки на 25 или 100 мл вводят в каждую колбу раствор йодида и в этот момент отмечают время начала реакции.
Через 15 минут после начала реакции берут пробу реакционной смеси (2 мл) и вливают в колбу на 250 мл, добавляют 50 – 70 мл воды и 1–2 капли крахмала. Затем с помощью бюретки на 50 мл пробу титруют раствором тиосульфата натрия 0,004 моль/л и определяют концентрацию йода. Титрование повторяют через 10 – 15 минут до тех пор, пока результаты предыдущего и последующего титрования не совпадут. Как известно, тиосульфат натрия реагирует с йодом по реакции 2 Na2S2O3 + J2 = Na2S4O6 + 2 NaJ, то есть с одним молем йода взаимо-действуют два моля тиосульфата натрия. Поэтому равновесная концентра-ция йода 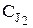 связана с объемом тиосульфата VТ и его концентрацией СТ
связана с объемом тиосульфата VТ и его концентрацией СТ
следующим образом: 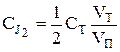 , где VП – объем пробы реакционной
, где VП – объем пробы реакционной
смеси. Так, для объема пробы VП = 2 мл, 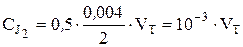 .
.
Подставляя это выражение в уравнение для константы равновесия реакции, получают:
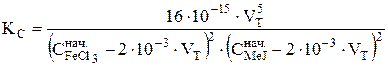 (36)
(36)
Начальные концентрации реагирующих веществ равны:
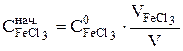 ;
;  .
.
Здесь С0 – концентрации исходных растворов, использованных для приго-товления реакционной смеси; 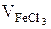 ,
, 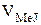 – объемы исходных растворов (см. табл.2) и V – общий объем реакционной смеси.
– объемы исходных растворов (см. табл.2) и V – общий объем реакционной смеси.
Таблица 2.
Варианты заданий по исследованию химического равновесия.
| Задание | Вариант | Объем в мл | |||
| FeCl3 | MeJ | HCl | H2O | ||
| I | 1 | ||||
| 2 | |||||
| 3 | |||||
| II | 4 | ||||
| 5 | |||||
| 6 | |||||
| III | 7 | ||||
| 8 | |||||
| 9 | |||||
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|