
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Химическое равновесие и условия его смещения.
Химическое равновесие и условия его смещения.
Химические реакции разделяют на обратимые и необратимые. Необратимыми являются реакции в одном направлении.
Например:
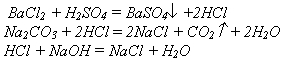
Большинство реакций являются обратимыми, т.е. реакции, протекающие в прямом и обратном направлениях.
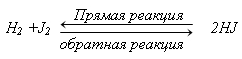
Химическое равновесие – состояние системы, при котором скорость прямой реакции равна скорости обратной реакции:
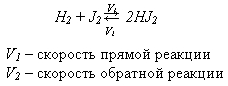
В состоянии равновесия прямая и обратная реакция не прекращаются, поэтому равновесие называют динамичным. Концентрации всех веществ остаются постоянными.
При изменении давления, температуры, концентрации веществ происходит смещение химического равновесия. Направление смещения равновесия определяется принципом Ле Шателье: если на систему, находящуюся в равновесии, производится внешнее воздействие (изменяется давление, температура, концентрация вещества), то оно способствует протеканию той из двух противоположных реакций, которая ослабляет воздействие.
При увеличении концентрации реагирующих веществ химическое равновесие смещается в сторону образования продуктов реакции; при увеличении концентрации продукции реакции – в сторону образования исходных веществ.
Равновесие обратимой реакции A + B C + Д смещается вправо при увеличении концентрации веществ A и B и уменьшении концентрации веществ C и Д.
Равновесие смещается влево при уменьшении концентрации веществ A и B и увеличении концентрации веществ C и Д.
Переход из одного равновесного состояния в другое равновесное состояние называется смещение или сдвигом равновесия. Если при изменении условий увеличивается скорость прямой реакции, говорят о смещении равновесия вправо().
Если при изменении условий увеличивается скорость обратной реакции, то равновесие смещается влево().
При увеличении давления химическое равновесие системы смещается в сторону той реакции, при которой объем образующихся газообразных веществ меньше. При увеличении давления равновесие смещается в сторону меньшего объема, а при уменьшении - в сторону большего объема.
Если исходные вещества и продукты реакции занимают одинаковый объем, то давление не будет влиять на смещение равновесия, например:
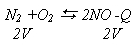
При повышении температуры химическое равновесие системы смещается в сторону эндотермической реакции; при понижении температуры – в сторону экзотермической реакции.
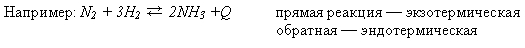
При увеличении температуры равновесие смещается влево () – в сторону эндотермической реакции; при уменьшении температуры равновесие смещается вправо () – в сторону экзотермической реакции.
Экзотермическая реакция — реакция идущая с выделением тепла, эндотермическая — с поглощением тепла.
Катализаторы не влияют на смещение химического равновесия, т.к. в главной мере ускоряют прямой и обратный процессы. Катализатор ускоряет только достижение химического равновесия.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|