
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
ХИМИЧЕСКОЕ РАВНОВЕСИЕ.
ХИМИЧЕСКОЕ РАВНОВЕСИЕ.
Химические реакции заключаются во взаимодействии реагентов с образованием продуктов реакциию. Не следует, однако, полагать, что направление химической реакции только одно. В действительности, химические реакции протекают и в прямом, и в обратном направлениях:
Реагенты  Продукты Продукты
|
Все химические реакции, в принципе, обратимы.
Это означает, что в реакционной смеси протекает как взаимодействие реагентов, так и взаимодействие продуктов. В этом смысле различие между реагентами и продуктами условное. Направление протекания химической реакции определяется условиями ее проведения (температурой, давлением,концентрацией веществ).
Многие реакции имеют одно преимущественное направление и для проведения таких реакций в противоположном направлении требуются экстремальные условия. В подобных реакциях происходит почти полное превращение реагентов в продукты.
Пример. Железо и сера при умеренном нагревании реагируют между собой с образованием сульфида железа (II), FeS при таких условиях устойчив и практически не разлагается на железо и серу:
Fe + S  FeS FeS
|
Пример. Реакция синтеза аммиака является обратимой:
N2 + 3H2  2NH3 2NH3
|
При 200 атм и 400 0С достигается максимальное и равное 36% (по объему) содержание NH3 в реакционной смеси. При дальнейшем повышении температуры вследствие усиленного протекания обратной реакции объемная доля аммиака в смеси уменьшается.
Прямая и обратная реакции протекают одновременно в противоположных направлениях.
| Во всех обратимых реакциях скорость прямой реакции уменьшается, скорость обратной реакции возрастает до тех пор, пока обе скорости не станут равными и не установится состояние равновесия. |
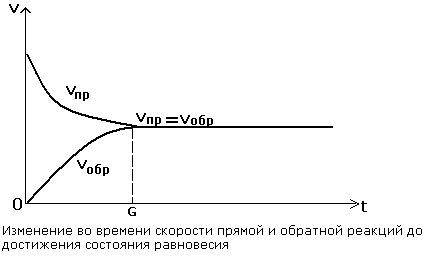
В состоянии равновесия скорости прямой и обратной реакции становятся равными.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|