
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
плавиковая кислота состоит из фтора и водорода
Анализ ПА по химии
Задание 3.Химический элемент и простое вещество.
Если речь идет о физических свойствах (агрегатное состояние, цвет, вкус и т.д.) или химических свойствах (с чем реагирует), то это ПРОСТОЕ вещество. В составе сплавов вещества сохраняют свои свойства.
3. Выберите два утверждения, в которых говорится о фторе как о химическом элементе
1) фтор получают электролизом
2) вода горит в атмосфере фтора
3) плавиковая кислота состоит из фтора и водорода
4) фтор реагирует со всеми металлами
5) зубная паста содержит фтор
Задание 5. Повторите материал по строению атома
5. Общим в строении атомов элементов 4 периода является
1) число электронов в атоме
2) величина зарядов ядер атомов
3) число электронных слоёв
4) число электронов на внешнем энергетическом уровне
Задание 10. Если перед формулой в уравнении реакции не написана цифра, значит коэффициент 1.
10. Сумма коэффициентов в уравнении реакции: H2SO4 + Zn = ZnSO4 + H2 равна
1) 7 2) 4 3) 8 4) 9
Задание 11. Задание 12.
Обратите внимание на запись ответа. Дана таблица. К каждой цифре надо подобрать букву. А не наоборот. В ПА неправильно записанные ответы проверять не буду.
Задание 11. ВБГА.
Задание 12. БГАВ
Задание 13. Задача.
13.К раствору нитрата серебра, содержащего 6 г нитрата серебра добавили избыток раствора йодида калия. Найдите массу образовавшегося осадка.
| Дано: m(AgNO3) = 6 г | Решение: (пояснения, написанные курсивом, писать в решении не надо) 1. составить уравнение реакции 0,035 моль х AgNO3 + KI = AgI↓ + KNO3 1 моль 1 моль По таблице растворимости определяем нерастворимое вещество Н, значит это вещество выпало в осадок. Это AgI. Возле формулы в уравнении пишем ↓
2. Находим количество вещества n известного соединения.
n(AgNO3) = 6 г / 170 г/моль = 0,035 моль M(AgNO3) = 108 + 14 + 16*3 = 170 г/моль
3. Подписываем в уравнении реакции над AgNO3 0,035 моль 4. Над формулой осадка AgI пишем х 5. В уравнении реакции под формулами (известного вещества и которое надо найти) пишем количество вещества (моль) по коэффициенту перед формулой. Если коэффициента нет, значит это 1. 6. Составляем пропорцию 0,035 моль = х 1 моль 1 моль
Х = 0,035 моль * 1 моль = 0,035 моль (AgI) (0,04 моль) 1 моль
7. Из формулы m = n * M m(AgI) = 0,035 моль (0,04 моль) * 235 г/моль = 8,225 г. (9,4 г) n(AgI) = 108 + 127 = 235 г/моль Ответ 8,225 г (9,4 г) |
| m(осадка ) - ? |
Задание 14.
А) NaOH +AlCl3=
Реакция обмена.
1. Положительно заряженную частицу из первой молекулы соединяем с отрицательной частицей из второй молекулы. Положительную частицу из второй молекулы соединяем с отрицательной частицей из первой молекулы
NaOH +AlCl3 = NaCl + AlOH
2. по таблице растворимости расставляем заряды ионов
NaOH +AlCl3 = Na+ Cl- + Al3+ OH-
3. по зарядам ионов находим индексы в молекулах
NaOH +AlCl3 = Na+ Cl- + Al3+ (OH-)3
4. расставляем коэффициенты в уравнении
3 NaOH +AlCl3 = 3 Na+ Cl- + Al3+ (OH-)3
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|
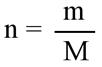
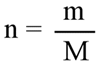 выводим m и находим массу осадка
выводим m и находим массу осадка