
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Комментарии 3 страница
По мере развития даосизма и под влиянием буддизма даосские представления о бессмертии сблизились с буддийскими. Понятие о бессмертии стало интерпретироваться как переход в иные реальности с другими жизненными циклами и другим течением времени.
Зороастризм[править | править код]
Зороастрийцы верят, что после смерти человека его душа покидает тело на четвёртый день, после чего попадает в рай либо в ад (возможно, зороастрийские представления о посмертном воздаянии повлияли на формирование соответствующих понятий в авраамических религиях). Изначально бессмертны Амешаспенты: шесть духовных первотворений Ахура Мазды, составляющие с ним «семёрку единосущных» — олицетворение семи ступеней духовного развития человека. Амеретат[en] («Бессмертие») — зороастрийский месяц, символизирующий вечную жизнь — стал прообразом месяца мордад (23 июля — 22 августа) в современном иранском календаре.
Авраамические религии[править | править код]

| Этот раздел статьи ещё не написан. Согласно замыслу одного или нескольких участников Википедии, на этом месте должен располагаться специальный раздел. Вы можете помочь проекту, написав этот раздел. |
Синкретические религии[править | править код]
Синкретические религии — верования и культы, которые образовались вследствие слияния различных религий или их элементов (манихейство, афрохристианство, бахаизм, сикхизм, хрислам, теософия, антропософия, фалуньгун и др.).

| Этот подраздел ещё не написан. Согласно замыслу одного или нескольких участников Википедии, на этом месте должен располагаться подраздел, посвящённый представлениям о бессмертии в синкретических религиях. Вы можете помочь проекту, написав этот подраздел. |
В философии[править | править код]

| Этот раздел не завершён. Вы поможете проекту, исправив и дополнив его. |
· Во многих своих сочинениях, например, «Метафизика пола и любви» Бердяев обожествлял «половую любовь», секс. Он писал: «С полом и любовью связана тайна индивидуальности и бессмертия».
· Бессмертие является центральной темой в философии русского космизма и трансгуманизма. Крупным теоретиком, философом-исследователем темы бессмертия и смерти является российский философ Игорь Владимирович Вишев.
· По мнению постмодерниста Жана Бодрийара, «отмена смерти — наш фантазм, развивающийся во все стороны: в религиях это фантазм загробной жизни и вечности, в науке — фантазм истины, в экономике — фантазм производительности и накопления»; бессмертие он называет всеобщим эквивалентом, связанным с «абстракцией линейного времени», которое формируется совместно с тем, «как время становится абстрактным параметром, связанным с процессом накопления в политической экономии и вообще с абстрагированием жизни»[8].
Наука о бессмертии[править | править код]
Основная статья: Иммортализм

| Возможно, эта статья содержит оригинальное исследование. Добавьте ссылки на источники, в противном случае она может быть выставлена на удаление. Дополнительные сведения могут быть на странице обсуждения. (25 мая 2011) |

| В этом разделе не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники. Эта отметка установлена 12 мая 2011 года. |
Некоторые ученые убеждены в том, что наука сможет решить проблему смертности человека.
Американский физик, лауреат Нобелевской премии Р. Фейнман: «Если бы человек вздумал соорудить вечный двигатель, он столкнулся бы с запретом в виде физического закона. В отличие от этой ситуации в биологии нет закона, который утверждал бы обязательную конечность жизни каждого индивида».
Современная наука идёт несколькими путями, решая проблему бессмертия физического тела человека. Значительная часть современных исследований в этой области направлена на решение проблемы старения. Для этих целей активно разрабатываются биомедицинские технологии использования стволовых клеток и генной инженерии, гормональная терапия, трансплантология и ряд других. Кроме этого, считаются перспективными разработки в области криобиологии, искусственного интеллекта.
В последнем случае, решение проблемы индивидуального физического бессмертия связывают с ожидаемым значительным прогрессом в микроэлектронике, благодаря которому станет возможным полноценный перенос на неорганический носитель сознания человека. Этот подход подвергся критике, в соответствии с которой «перенос сознания» якобы нельзя назвать бессмертием с точки зрения самого человека, подвергаемого этой операции, поскольку записанное на внешний носитель сознание в соответствии с этой точкой зрения будет являться всего лишь точной копией индивидуальности, но не самой индивидуальностью.
Проект SENS[править | править код]
Обри ди Грей, автор научно-популярной книги «Конец старости» (англ. Ending Aging), в которой в деталях рассматривается вопрос о полной победе над старением средствами медицины в течение ближайших нескольких десятилетий. Разработчик концепции SENS — «стратегии достижения пренебрежимого старения инженерными методами» (англ. strategies for engineered negligible senescence)[9]. Председатель и директор по науке Фонда SENS[10], главный редактор академического журнала Rejuvenation Research. По мнению Грея, большая часть фундаментальных исследований, необходимых для создания эффективной «медицины антистарения» (англ. anti-aging medicine), уже проведены. В настоящий момент главная проблема — недостаток финансирования работ в этой области. Фонд присуждает крупные денежные премии исследователям, добившимся значительного увеличения продолжительности жизни лабораторной мыши (на февраль 2007 года премия составляла 4,2 миллиона долларов).
В культуре[править | править код]
В литературе[править | править код]

| Возможно, этот раздел содержит оригинальное исследование. Добавьте ссылки на источники, в противном случае он может быть удалён. Дополнительные сведения могут быть на странице обсуждения. (25 мая 2011) |
Во многих литературных произведениях, в том числе и насчитывающих тысячи лет, есть идеи бессмертия. Бессмертными были Боги из «Илиады» и «Одиссеи» Гомера, струльдбруги Джонатана Свифта (для Богов бессмертие является даром, для струльдбругов — проклятием). В сказочной литературе мотивы бессмертия и воскрешения мёртвых встречаются настолько часто, что несомненно — в сказках отражается давняя мечта человечества о бессмертии. Однако примечательно то, что, как правило, к бессмертию стремятся (да и получают его) в основном отрицательные персонажи. Причём сами эти персонажи получают бессмертие, как правило, или в результате превращения в нежить, призраков, личей, живых мертвецов, вампиров и т. д., или в результате соглашения с силами зла, или при помощи чёрной магии. При этом в последнем случае, если бессмертие необходимо поддерживать, они, как правило, вынуждены пользоваться соответствующей магией и впоследствии. Таковы Кощей Бессмертный из русских народных сказок, Волан-де-Морт Джоанны Роулинг, Госпожа Бай Гу (Личесса) из романа У Чэнъэня «Путешествие на Запад», Михай Годой из «Хроник Арции» Веры Камши, назгулы у Толкина, граф Дракула и др.
Напротив, положительные герои к бессмертию если и стремятся, то не для себя, а для других (классические примеры — Иван-Царевич, Гильгамеш), а если сами его и получают, то в качестве награды от кого-то за какие-то заслуги.
Интересно решается проблема бессмертия в сценарии братьев Стругацких «Пять ложек эликсира» — герой отказывается от права на вечную жизнь, убедившись в мелочности и ограниченности бессмертных, с которыми он, волей случая, становится знаком. Теме обретения «вечной жизни» (а главное — цены за неё) посвящены, например, роман Роберта Силверберга «Книга черепов» и фантастический рассказ Александра Ломма «Скафандр Агасфера».
Нейросфе́ра — сферообразное скопление нейрональных стволовых клеток либо клеток-предшественников in vitro[1] (при помещении их в среду, не содержащую сыворотки). При внесении нейросферы в сыворотку клетки начинают дифференцироваться и выходить за пределы скопления.
Индуцированные стволовые клетки (иСК) — стволовые клетки, полученные из каких-либо иных (соматических, репродуктивных или плюрипотентных) клеток путём эпигенетического перепрограммирования. В зависимости от степени дедифференцировки клетки при перепрограммировании различают: индуцированные тотипотентные, индуцированные плюрипотентные стволовые клетки (ИПСК) и получаемые так называемым прямым перепрограммированием или каким-либо иным способом[5] индуцированные прогениторные (мультипотентные или унипотентные) стволовые клетки, иногда называемые также индуцированными соматическими стволовыми клетками (ИССК).
В настоящее время существует три пути перепрограммирования соматических клеток в плюрипотентные стволовые клетки[6]:
1. пересадка ядер, взятых из соматических клеток, в оплодотворенную яйцеклетку, из которой предварительно удалено ядро[1][7]
2. слияние соматических клеток с плюрипотентными стволовыми клетками[8];
3. модификация соматической клетки, индуцирующая её превращение в стволовую клетку, с помощью: генетического материала, кодирующего белковые репрограммирующие факторы[9][10][11]; рекомбинантных белков[12][13]; микроРНК[14][15][16][17][18], синтетической самореплицирующейся полицистронной РНК[3] и низкомолекулярных биологически активных веществ
Природные процессы индукции[править | править код]
Ещё в 1895 году Томас Морган, удалив один из двух бластомеров лягушки, обнаружил, что оставшаяся часть эмбриона способна, тем не менее, воссоздать цельный эмбрион. Это означало, что клетки, при необходимости, способны изменять направление своей специализации и такое изменение скоординировано. Позднее в 1924 году, Шпеманн и Мангольд (Spemann and Mangold) показали, что важнейшую ключевую роль в процессах развития животных играют межклеточные взаимодействия называемые индукцией[24]. Метаплазией называют обратимую замену одного дифференцированного типа клеток на другой тип зрелых дифференцированных клеток[25]. Этот переход от одного типа клеток к другому может быть частью нормального процесса созревания или вызван каким-то индуцирующим его стимулом. Примерами этого перехода можно назвать трансформацию клеток радужной оболочки глаза в линзу в процессе созревания и превращение клеток пигментного эпителия сетчатки в нейральную сетчатку при регенерации глаза у взрослых тритонов. Этот процесс позволяет организму заменить исходные клетки, не подходящие к новым условиям, на новые которые больше подходят к новым условиям. В опытах на клетках имагинальных дисков дрозофилы было обнаружено, что существует ограниченное число стандартных дискретных состояний дифференцировки и клеткам приходится выбирать одно из них. Тот факт, что трансдетерминация (смена пути дифференцировки) часто происходит не в одной, а сразу в группе клеток доказывает, что она вызвана не мутацией, а именно индуцирована[26][27].
К настоящему времени удалось выявить минимальные условия и факторы, наличия которых достаточно для индукции каскада молекулярных и клеточных процессов, направляющих дифференцировку и самоорганизацию плюрипотентных клеток в эмбрион. Роль морфогенов, как оказалось, выполняют противоположно направленные градиенты концентрации морфогенетического белка костной ткани (BMP) и белка Nodal[en][28].
Некоторые типы зрелых, специализированных клеток взрослого организма способны естественным путём вернуться к стадии стволовой клетки[29]. Например, дифференцированные клетки желудка, называющиеся аделоморфными или «главными клетками» и синтезирующие маркер стволовых клеток Troy, обычно производят пищеварительные жидкости. Однако, они могут при необходимости превратиться обратно в стволовые клетки для «ремонтных работ» в случае травм желудка, таких как порез или повреждение вызванное инфекцией. Более того, они осуществляют этот переход даже в отсутствие заметных травм и способны восполнить пул всех клеточных линий желудочного эпителия, по существу, выступая в качестве покоящихся «резервных» стволовых клеток[30]. При повреждении трахеи, дифференцированные эпителиальные клетки дыхательных путей могут вернуться к фенотипу стабильных и функциональных стволовых клеток, если, однако, они не имеют непосредственного контакта с базальной стволовой клеткой, которая предотвращает подобную дедифференцировку[31]. Зрелые терминально дифференцированные эпителиальные клетки почки, после травмы, способны дедифференцироваться в свои более ранние версии, а затем снова дифференцироваться в типы клеток нуждавшихся в замене в поврежденной ткани[32]. Макрофаги могут самообновляться путём локальной пролиферации зрелых дифференцированных клеток[33]. Это происходит, когда понижаются концентрации или происходит ингибирование двух факторов транскрипции MafB и c-Maf, препятствующих активации программы самообновления[34]. У тритонов мышечная ткань восстанавливается из специализированных мышечных клеток, которые для этого дедифференцируются забыв свою прежнюю специализацию. Эта способность к регенерации тканей не уменьшается с возрастом, что вероятно связано со способностью тритонов при необходимости образовывать из мышечных клеток новые стволовые клетки[35].
Следует отметить, что в организме существует небольшой процент стволовых клеток, способных генерировать множество различных типов клеток. Например, мультилинейно-дифференцирующиеся устойчивые к стрессу (англ. muse cell) стволовые клетки взрослого человека обладают способностью к самообновлению и образуют в суспензионной культуре характерные скопления (кластеры) плюрипотентных клеток, которые могут дифференцироваться как in vitro, так и in vivo в энтодермальные, эктодермальные и мезодермальные клетки[36][37][38][39][40][41]. Они также легко перепрограммируются в ИПСК[42][43].
Подробное описание некоторых других хорошо документированных примеров трансдифференцировки[en] in vivo и их роль в развитии и регенерации рассматриваются в обзоре[44][45].
Индуцированные тотипотентные клетки (иТК)[править | править код]
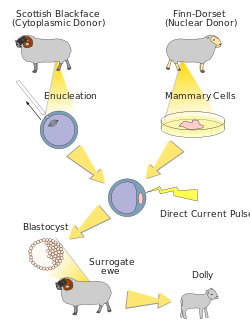
Схема клонирования Долли
Перепрограммирование в иТК с помощью SCNT[править | править код]
Индуцированные тотипотентные клетки обычно используют для клонирования[46] и получения генетически модифицированных животных[47]. Эти клетки можно получить с помощью перепрограммирования соматических клеток путём переноса ядер соматических клеток (Somatic cell nuclear transfer — SCNT) в ооциты-реципиенты[1][48][49][50][51][52]. При этом ооциты не обязательно должны принадлежать тому же виду. Иногда удается использовать ооциты других видов, например овец[53] или поросят[54]. И хотя эффективность межвидовой SCNT была примерно в три раза ниже обычной, такие эмбрионы удавалось довести до стадии бластоцисты[54]. Эффективность перепрограммирования можно повысить в два раза, если за сутки до пересадки остановить мейоз ооцитов-реципиентов с помощью бутиролактона1 в комбинации с нейротрофическим фактором мозга (BDNF)[55]. Кроме того, эффективность клонирования может быть значительно повышена, а процедура SCNT упрощена благодаря использованию ингибиторов гистондеацетилазы, таких как трихостатин А[56] и ингибиторов полимеризации цитоскелетного актина таких как цитохалазин В или латранкулин A (latrunculin A)[57]. Для полноценного развития образующихся эмбрионов необходимо также предварительно уменьшить метилирование лизина 4 в молекуле гистона H3 в клетках донорах ядра[58]. Кроме того для полноценного развития эмбриона необходимы также экзосомы выделяемые его клетками.[59]
Повторное клонирование на протяжении 25 поколений жизнеспособных мышей с помощью метода SCNT, основанном на добавлении в среду клеточной культуры ингибитора деацетилазы гистонов — трихостатина А,[56] показало, что можно достаточно долго (на протяжении 16 лет) неоднократно повторно клонировать животных без видимого накопления нарушений в геноме[60].
До настоящего времени бытует представление о возможности преждевременного старения клонированных животных, полученных методом SCNT. Показано, что теломеры у эмбрионов клонированных свиней, полученных с помощью стандартных методов SCNT хуже восстановлены, по сравнению с эмбрионами образующимися по естественному пути. Обработка же трихостатином А значительно увеличивает длину теломер у клонированных свиней и это может быть одним из механизмов, лежащих в основе улучшенного развития клонированных животных, после обработки трихостатином А[61].
При использовании технологии SCNT разработанной Миталиповым[1] можно получать ЭСК человека используя ядра из фибробластов кожи даже пожилых людей, что открывает широкие перспективы для технологий регенеративной медицины[62][63][64]
Разработан метод, открывающий новые возможности для создания генетически модифицированных животных с помощью гаплоидных эмбриональных стволовых клеток, которые могут быть использованы вместо спермы. Для этого из ооцита удаляют ядро. Затем в него вводят микроинъекцией сперму. Из образующейся в результате этого бластоцисты получают гаплоидные эмбриональные стволовые клетки. Эти клетки, синхронизованные в М фазе, вводят в ооцит вместо спермы, в результате чего развивается жизнеспособное потомство[65]. Эти разработки, вместе с данными о возможности неограниченного получения ооцитов из митотически активных половых стволовых клеток[66], открывают возможность промышленного производства трансгенных сельскохозяйственных животных. Так, в Китае с помощью упрощенной техники клонирования получены трансгенные овцы, у которых улучшено качество мяса и молока за счет увеличения в них незаменимых ненасыщенных жирных кислот, которые снижают риск развития ишемической болезни сердца и необходимы для поддержки глаз и головного мозга. Ген, вызывающий синтез ω-3 полиненасыщенных жирных кислот успешно удалось передать трансгенной овце. Клонирование животных для исследовательских целей в Китае уже приобрело промышленные масштабы. Одних только различных клонов поросят производится порядка 500[67].
Подобные технологии могут также найти клиническое применения для преодоления цитоплазматических дефектов в ооцитах человека[68]. Например, разработаны технологии, которые могут воспрепятствовать нежелательному наследованию митохондриального заболевания, которое передается следующему поколению. Митохондрии, которые часто называют «электростанцией клетки», содержат генетический материал, который передается от матери к ребёнку. Мутации митохондриальной ДНК могут вызвать диабет, глухоту, заболевания глаз, желудочно-кишечные расстройства, болезни сердца, деменцию и ряд других неврологических заболеваний. Пересадкой ядра из яйцеклетки одного человека (несущей дефектную митохондриальную ДНК) в другую (здоровую) можно эффективно заменить цитоплазму клетки и вместе с ней митохондрии (и их ДНК)[69]. Полученная таким образом яйцеклетка может рассматриваться как имеющая двух матерей. Эмбрион образующийся после оплодотворения такой яйцеклетки будет иметь здоровую митохондриальную ДНК[70]. Однако насколько оправданы подобные манипуляции с клетками человека с точки зрения биоэтики пока не ясно[71].
Подробнее о новейших достижениях техники клонирования и получении тотипотентных клеток с помощью SCNT см.:[72][73]
Перепрограммирование в иТК без помощи SCNT[править | править код]
До недавнего времени получить тотипотентные клетки удавалось лишь с помощью SCNT. Однако появились работы где было продемонстрировано получение иТК с помощью перепрограммирования факторами Яманаки in vivo[74][75], а также in vitro с помощью таких эпигенетических факторов ооцита как зародышевая изоформа гистонов[76]. Перевести эмбриональные стволовые клетки в состояние тотипотентности характерное для ранних эмбрионов 2-клеточной стадии можно также путём подавления активности CAF-1 необходимой для сборки хроматина[77]. От превращения ЭСК и ИПСК в тотипотентные клетки, способные дать начало таким внеэмбриональным тканям как плацента и желточный мешок, плюрипотентные стволовые клетки, по-видимому, так же удерживает микроРНК-34а[78]. Ингибирование её синтеза приводит к активации экспрессии эндогенного ретровируса MuERV-L и расширяет потенциал плюрипотентных стволовых клеток до способностей клеток стадии двух бластомеров[79].
Разработан химический коктейль для получения так называемых плюрипотентных стволовых клеток с расширенными возможностями по дифференцировке — они могут дать начало как клеткам эмбриона, так и внеэмбриональным тканям. Такие супертотипотентные клетки (иСТК) могут быть использованы для получения химер с целью выращивания органов в организме животных[80][81]
Получение репродуктивных клеток из ИПСК[править | править код]
Используя среды, содержащие ретиноевую кислоту и фолликулярную жидкость свиньи, можно получить in vitro, дифференцировкой из ИПСК, клетки ранних стадий гаметогенеза подобные репродуктивным клеткам, из которых образуются сперма и ооциты[82][83][84]. Примечательно, что для образования примордиальных половых клеток человека требуется активность двух ключевых регуляторов: гена SOX17 направляющего дифференцировку в сторону образования предшественников половых клеток и Blimp1 подавляющего энтодермальные и другие соматические гены во время этой специализации[85].
В статье китайских ученых с первым автором Чжоу (Zhou) описана технология дифференциации мышиных эмбриональных стволовых клеток которые претерпевают мейоз in vitro превращаясь в гаплоидные сперматиды, способные к оплодотворению, о чём свидетельствовало получение с их помощью жизнеспособного и фертильного потомства[86][87].
Подробный обзор методов искусственного получения мужских половых клеток можно найти в статье Hou с соавт.[88] и Irie, Kim, Surani[89]
Разработана технология позволяющая получать зрелые ооциты in vitro из эмбриональных стволовых клеток, а также из индуцированных плюрипотентных стволовых клеток, полученных из взрослых фибробластов взятых с кончика мышиного хвоста. Более того оплодотворив такие яйцеклетки in vitro и подсадив их в матку мыши удалось с выходом в 1 % получить жизнеспособное потомство[90][91][92]. Эта технология послужит платформой для выяснения молекулярных механизмов, лежащих в основе тотипотентности и для разработки методов производства ооцитов из других (в том числе редких) видов млекопитающих в лабораторных условиях.
ИПСК как результат радикального омоложения[править | править код]
Основная статья: en:Induced pluripotent stem cells
Если поместить клетки тератокарциномы в ранний зародыш млекопитающего (на стадии бластоцисты), то они включаются в состав клеточной массы бластоцисты и из такого химерного (то есть состоящего из клеток от разных организмов) эмбриона нередко развивается нормальное химерное животное. Почти во всех органах и тканях таких животных часть дифференцированных клеток происходит из клеток тератокарциномы, которые совместно с клетками нормального происхождения участвуют в построении здорового организма. Аналогичная трансплантация клеток тератокарциномы во взрослый организм неизменно приводит к развитию тератокарциномы.
Впервые ИПСК были получены в виде перевиваемой тератокарциномы, индуцированной трансплантатом, взятым из мышиных эмбрионов[93]. Было доказано, что тератокарциномы образуются из соматических клеток[94]. Тот факт, что из клеток тератокарциномы можно получить нормальную мышь доказывал их плюрипотентность[95][96][97]. Оказалось, что клетки тератокарциномы, выделяя в культуральную среду различные факторы, способны поддерживать культуру плюрипотентных стволовых клеток эмбриона в недифференцированном состоянии[98]. Таким образом, ещё в 1980-е годы стало ясно[99][100][101], что трансплантация плюрипотентных или эмбриональных стволовых клеток во взрослый организм млекопитающих обычно приводит к образованию тератомы, которая затем может превратиться в злокачественную опухоль — тератокарциному[102]. Если, однако, поместить клетки тератокарциномы в ранний зародыш млекопитающего (на стадии бластоцисты), то они включаются в состав клеточной массы бластоцисты и из такого химерного (то есть состоящего из клеток от разных организмов) эмбриона нередко развивается нормальное химерное животное. Почти во всех органах и тканях которого часть дифференцированных клеток происходит из клеток тератокарциномы, которые совместно с клетками нормального происхождения участвуют в построении здорового организма[100][101][103]. Это свидетельствовало о том, что причиной образования тератомы является диссонанс в стадии развития донорных клеток и окружающих их клеток реципиента (так называемой ниши). Уже тогда, используя ретровирусные векторы, удалось ввести инородные гены в мышиные химеры, полученные с помощью клеток тератокарциномы[104].
Японские исследователи Такахаси и Яманака разработали систему отбора факторов плюрипотентности, использующую фибробласты, содержащие кассету устойчивости к антибиотику неомицину с промотором гена Fbx15, который активен в раннем эмбрионе, но не экспрессируется в фибробластах[105] Для индукции перепрограммирования, авторы заражали тестирующие фибробласты ретровирусными векторами, каждый из которых нес уникальную кольцевую ДНК, кодирующую ген молекулы кандидата в факторы перепрограммирования. Если ядерное перепрограммирование произошло, то эти фибробласты должны синтезировать β-галактозидазу и стать устойчивыми к высоким концентрациям неомицина[2]
В августе 2006 года японские исследователи сумели превратить клетки мышиной кожи (фибробласты) в индуцированные плюрипотентные стволовые клетки — ИПСК (induced pluripotent stem cells — iPSC), используя для модификации клетки всего четыре репрограммирующих фактора: Oct4, Klf4, Sox2 и c-Myc, доставленных в ядро ретровирусами[2]. Этим они доказали, что гиперэкспрессия небольшого количества факторов иногда может подтолкнуть клетки к переходу в новое стабильное состояние, связанному с изменениями активности тысяч генов. По своим свойствам ИПСК оказались очень похожи на эмбриональные стволовые клетки (ЭСК)[106]. Так, сравнение протеома и фосфопротеома ЭСК и ИПСК, проведенное на 4-х линиях человеческих эмбриональных стволовых клеток и 4-х линиях индуцированных плюрипотентных стволовых клеток, показало, что большинство идентифицированных белков и участков фосфорилирования в белках всех линий совпадают. Хотя были и небольшие, но статистически воспроизводимые различия, свидетельствующие об определённом функциональном различии[107]. Не было отмечено и особых изменений в последовательности ДНК, особенно если ИПСК были получены с помощью неинтегрирующихся в геном плазмид[108]. Позднее, с развитием технологии перепрограммирования, лучшим доказательством идентичности ИПСК и ЭСК стала возможность получения взрослой мыши полностью из некоторых линий ИПСК[109][110]. Несмотря на то, что рядом исследований была доказана идентичность ЭСК и ИПСК[111], получаемые клоны сильно отличаются друг от друга и не для всех из них можно доказать идентичность с ЭСК[112], далеко не все клоны способны дать жизнь химерным мышам или подвергнуться эффективной дифференциации в те или иные соматические клетки. Одной из причин таких различий является разница между составом транскрипционных факторов при репрограммировании в ИПСК и набором факторов в материнском ооците. К числу таких «упущенных» факторов относится, в частности способствующий процессу репрограммирования особый, характерный для ооцитов линкерный (связующий, компонующий нуклеосомы) гистон H1foo[113]. Замена одного из факторов Яманаки, а именно c-Myc на H1foo, значительно повысили количество и качество получаемых клонов ИПСК — они стали более однородными по свойствам, из них чаще стали получаться мыши-химеры[113].
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|