
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Тестовый контроль «Гетерогенные равновесия осадок-раствор. Равновесия в растворах комплексных соединений»
РАВНОВЕСИЯ В РАСТВОРАХ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ. ГЕТЕРОГЕННЫЕ РАВНОВЕСИЯ
Комплексные соединения
1. Для комплексных соединений K2[PtBr4]; [Cu(NH3)4]Cl2; [Fe(CO)5]; укажите внутреннюю и внешнюю сферы, центральный атом-комплексообразователь, его координационное число (КЧ), степень окисления, лиганды и их дентантность. Напишите уравнения их первичной и вторичной диссоциации и выражение для Kуст.
2. В приведенных ниже комплексах укажите ион-комплексообразователь, его степень окисления и координационное число. Каков заряд комплексной частицы? Укажите лиганды, их заряд и дентатность, координирующие (донорные) атомы в лигандах.
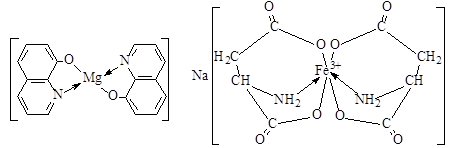
а) комплекс 8-гидроксихино- б) комплекс аспарагиновой кислоты
лина с магнием с железом(III)
3. Определить концентрацию ионов Fe3+ в 0,01 М растворе K3[Fe(CN)6] и степень диссоциации комплексного иона. Kнест комплексного иона [Fe(CN)6]3– равна 1,0 × 10–42.
Решение
1) Поскольку взаимодействие между внешней и внутренней координационными сферами носит чисто ионный характер, то при растворении в воде или других ионизирующих растворителях координационные соединения подвергаются полной диссоциации на внутреннюю и внешнюю сферы (первичная диссоциация):
K3[Fe(CN)6] → 3K+ + [Fe(CN)6]3–
0,01 0,03 0,01
2) Диссоциация внутренней сферы (вторичная диссоциация) — процесс обратимый:
[Fe(CN)6]3– D Fe3+ + 6CN–
Обратимая диссоциация внутренней сферы координационного соединения может быть количественно охарактеризована соответствующей константой равновесия, называемой константой нестойкости (Kнест).
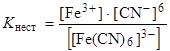
Пусть диссоциации подвергнется x моль/л ионов [Fe(CN)6]3–, тогда:
[Fe(CN)6]3– D Fe3+ + 6CN–
сисх, моль/л 0,01 0 0
Δс, моль/л –x +x +6x
сравн, моль/л 0,01 – x x 6x
Подставляя равновесные концентрации ионов Fe3+, CN– и [Fe(CN)6]3– в выражение получаем:
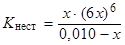
Значение Kнест комплексного иона [Fe(CN)6]3– равно 1,0 × 10–42. Поскольку эта величина очень мала, то диссоциации подвергнется лишь незначительное количество ионов [Fe(CN)6]3–, поэтому 0,010 – x ≈ 0,010. Тогда
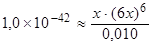 ,
,
откуда x ≈ 1,1 × 10–7 моль/л. Следовательно, степень диссоциации (α) комплексного иона [Fe(CN)6]3– в его 0,01 М растворе составит лишь 1,1 × 10–7/0,01 = 1,1 × 10–5 = 0,0011%.
Ответ: с(Fe3+) = 1,1 × 10–7 моль/л; α = 0,0011%
Задача для самостоятельного решения
4. Напишите уравнения первичной и вторичной диссоциации комплекса [Ag(NH3)2]NO3. Рассчитайте концентрацию иона-комплексообразователя в его 0,352 M растворе, если Kуст[Ag(NH3)2]+ = 1,12×107. Как изменится его концентрация, если к его раствору добавить аммиак?Ответ: c = 2×10–3 моль/л; уменьшится.
Гетерогенные равновесия
5. Рассчитайте молярные концентрации ионов Ag+ и SO42– в насыщенном растворе сульфата серебра, если известно, что константа произведения растворимости сульфата серебра в этих условиях равно 3,2 ∙ 10–5.
Решение:
В насыщенном растворе существует равновесие между твердой солью и ионами в растворе. Если при образовании 1 литра насыщенного раствора растворилось х моль сульфата серебра, то концентрация ионов Ag+ равна 2х, а концентрация ионов SO42– — х моль/л:
Ag2SO4 (осадок) ⇄ 2Ag+(раствор) + SO42–(раствор)
x 2х х
Kпр = [Ag+]2 ∙ [SO42–] = (2х)2 ∙ х = 4х3.
х = 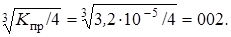
Ответ: с(Ag+) = 0,04 моль/л; с(SO42–) = 0,02 моль/л.
Задачи для самостоятельного решения
6. Константа произведения растворимости бромида серебра при 25 °C составляет 6×10–13. В каком минимальном объеме воды можно растворить 150 мг этой соли? Ответ: V(Н2О) = 1031 л
7. Какова растворимость (моль/л) оксалата кальция (KПР = 2,0×10–9) в воде и растворимость этой соли в 0,01 M растворе CaCl2? Ответ: 4,47×10–5 и 2,0×10–7
8. Выпадет ли осадок CaCO3 при сливании равных объемов 0,02 M раствора Ca(NO3)2 и 0,004 M раствора K2CO3? KПР(CaCO3) = 3,4×10–9.Ответ: Пс = 2×10–5, выпадет.
Тестовый контроль «Гетерогенные равновесия осадок-раствор. Равновесия в растворах комплексных соединений»
1. Оцените истинность утверждений:
1) KПР не зависит от температуры;
2) осадок малорастворимого сильного электролита образуется, если Пс> KПР
а) верно; б) неверно
2. Какие утверждения верно определяют понятие «координирующие атомы»?
а) частицы (молекулы, ионы), содержащие один или несколько атомов – доноров электронных пар;
б) атомы в лиганде, непосредственно связанные с центральным атомом (ионом)-комплексообразователем;
в) частицы (атомы, ионы), содержащие один или несколько атомов – доноров электронных орбиталей;
г) частицы, способные к образованию ионных связей.
3. В насыщенный раствор карбоната кальция добавили небольшое количество раствора NaCl. Растворимость CaCO3 при этом:
а) практически не изменится; б) увеличится; в) уменьшится.
4. Чему равна молярная растворимость (моль/л) CuS, если KПР(CuS)=6,3×10–36:
а) 2,5×10–18; б) 6,3×10–36; в) 2,5×10–26.
5. Для более полного осаждения ионов Cd2+ из насыщенного раствора СdS к нему необходимо добавить:
а) Na2S; б) Cd(NO3)2; в) K[Cd(CN)4].
6. Расположите катионы в порядке последовательности их осаждения при добавлении в раствор Na2CO3, если KПР(BaCO3) = 3,9×10–10; KПР(PbCO3) = 7,5×10–14; KПР(CdCO3) = 1,0×10–12:
а) Pb2+; б) Cd2+; в) Ba2+.
7. Установите соответствие между структурой комплексного соединения и классом (типом) координационных соединений, к которому оно относится:
| 1) | [Pt(en)Cl2] | а) | анионный |
| 2) | [Сu(NH3)4](OH)2 | б) | нейтральный |
| 3) | [Cr(en)2Cl2][Fe(CN)6] | в) | катионный |
| 4) | K3[Fe(CN)6] | г) | смешанного типа |
| en | = NH2CH2CH2NH2 |
8. Определите степень окисления и координационное число атома железа в комплексном соединении Na3[Fe(CN)5Cl]:
а) +3 и 6; б) +2 и 5; в) +2 и 6; г) +3 и 5.
9. Определите заряд комплексного иона и число лигандов в комплексном соединении [Cr(OH)2(H2O)4]Cl:
а) 1+ и 6; б) 2+ и 4; в) 1– и 6; г) 3+ и 6.
10. Расположите в порядке возрастания концентрации иона-комплексо-образователя в 0,01 М растворах комплексных ионов, если их Kнест равны: Kнест[Hg(CN)4]2– = 4,0×10–42; Kнест[Co(CN)4]2–= 1,4×10–19; Kнест[Cu(NH3)4]2+ = 2,14×10–13.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|