
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Вопросы для самоконтроля по теме 1.
В содержание предмета входит изучение кремния, его физических и химических свойств, способов получения элементарного кремния, распространение в природе. Виды кремния, его бициклический цикл, соединения на основе кремния: бинарные, кислородные, соли кремниевых кислот, формы полиморфных превращений кремнезема. Силикаты. Виды силикатов. Их роль в производстве тугоплавких и силикатных материалов и изделий. Рассматриваются различные химические процессы в силикатной промышленности, связанные с превращением кремния и его различных соединений; научные перспективы развития силикатной промышленности, новые материалы на основе кремния, алюминия, кислорода и азота (сиалоны). Рассматриваются в содержании и вопросы, связанные с охраной окружающей среды при работе с соединениями кремния, их обработкой.
Тема 1. Кремний
При изучении данной темы необходимо дать определение кремния, т.е. его химическую формулу (Si), его химическое название (силициум), расположение в таблице элементов Д.И.Менделеева (находится в 3 периоде, 4 группе). Его порядковый номер (14), атомный вес (28,085), его электронную конфигурацию:
1s22s22p63s23p2 – в невозбужденном состоянии
1s22s22p63s13p3 – в соединениях
Виды кремния:
3 стабильных изотопа 28Si, 29Si, 30Si,
радиоактивные изотопы, их 5: 25Si, 26Si, 27Si, 31Si, 32Si
В свободном виде в природе кремний не встречается, хотя является самым распространенным элементов после кислорода. Его содержание по массе около 28%. Он входит в состав многих минералов, горных пород, силикатов. Известно более 800 природных кремнийсодержащих минералов. Наиболее широко распространены его оксидные соединения и силикаты, из которых состоит 87% массы литосферы, сложенной из базальтовых, гранитных и осадочных пород.
В важнейшей части биосферы – почве – содержится кремния до 85-87%. В гидросфере кремний находится в виде растворенной кремниевой кислоты. Концентрация SiO2 в водах Земли составляет 5·10-3 кг/м3. В атмосфере в небольших количествах в виде пыли, состоящей из части горных пород. Кремний встречается в составе всех космических тел. Например, порода луны содержит 19% Si или 41% SiO2. Кремний содержится практически во всех тканях и органах животных и человека и выполняет активную роль в жизненных процессах. Соединения кремния придают прочность, эластичность, непроницаемость эпительным и соединительным тканям. Кремний способствует образованию костных тканей. Кремний принадлежит к числу циклических элементов природы, совершающих непрерывный круговорот в земной коре. Кремний относится к числу элементов, имеющих биологический цикл. Он начинается с выветривания горных пород, разрушения силикатов и высвобождения из них кремнезема.
K2O·Al2O3·6SiO2 + H2O + CO2 = Al2O3·2SiO2·2H2O + 4SiO2 + K2CO3
Кремнезем активно усваивается низшими растительными организмами (водорослями, лишайниками и т.д.) и, претерпев ряд видоизменений, преобразований, возвращается в почву в виде аморфного кремнезема, который усваивается высшими растениями, организмами. Так начинается новый цикл, совершается круговорот кремния в природе.
Физические свойства кремния. Кремний принадлежит к тугоплавким неметаллическим веществам. Занимает в таблице промежуточное положение между металлами и неметаллами. В природе встречается по агрегатному состоянию в двух видах: кристаллическом и аморфном. Плотность кристаллического кремнезема 2420 кг/м3, аморфного 2350 кг/м3, твердость по Моосу 7-6,5, температура плавления 17280С, кипения 32470С, электропроводность, теплопроводность зависят от чистоты, примеси изменяют их. Аморфный кремний – порошок бурого цвета, с температурой плавления 14230С.
В кристаллах кремния даже при обычных условиях ковалентные связи частично разрушаются, поэтому в нем появляются свободные электроны, которые обуславливают небольшую электропроводность. При наличии примесей, нагревании, освещении число разрушающихся связей увеличивается, увеличивается число свободных электронов, а значит увеличивается электропроводность. Кристаллизуется кремний в кубической сингонии по типу решетки алмаза. В его кристалле каждый атом окружен тетраэдрически четырьмя другими атомами и связан ковалентной связью. Монокристаллы кремния получают выращиванием в вакууме из расплава медленным вытягиванием.
Химические свойства кремния. Химические свойства кремния определяются особенностями электронного строения атома кремния, по структуре строения он похож на атом углерода. Распределение электронов в атоме кремния можно представить так:
| S | |||||||||
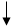 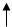 K K
| P | ||||||||
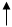 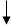 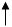 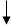  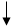  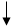 L L
| d | ||||||||
    M M
|
Как видно из структуры последнего электронного валентного слоя, кремний может проявлять в своих соединениях валентность переменную от 2 до 4-х. В кристаллическом состоянии он при обычных условиях инертен, аморфный – более реакционно-способный.
Высокодисперсный аморфный кремнезем вступает в реакцию с парами воды и водорода, обратно не выделяя их.
Si0 + 2H2 = SiH4 ↑ силан
Si0 + H2O = SiO2 + H2 ↑
При обычных условиях взаимодействует только с фтором
| +4 -1 | ||
| Si0 + 2F20 | = | SiF4 |
При температуре 400-6000С вступает в реакцию с хлором, бромом, сгорает в токе кислорода.
| t0 | +4 -1 | |
| Si0 + 2Cl20 | = | SiCl4 |
| t0 | +4 -1 | |
| Si0 + 2Br | = | SiBr4 |
| t0 | +4 -2 | |
| Si0 + O20 | = | SiO2 |
При температуре от 1000 до 15000С реагирует с углеродом, азотом, образуя карбид и нитрид кремния:
| t0 | +4 –4 | ||
| Si0 + С0 | = | SiС | (карбид кремния, карбомид) |
| t0 | +4 –3 | ||
| Si0 + N20 | = | Si3N4 | (нитрид кремния) |
Во всех этих реакциях кремний выступает как восстановитель.
Как восстановитель кремний выступает и при взаимодействии с некоторыми сложными веществами, например, с фторводородной кислотой:
| + - | t0 | +4 - |
| Si0 + 4HF | = | SiF4 + 2H20 ↑ |
С другими кислотами он не взаимодействует, т.к. образуется оксидная пленка SiO2.
На холоде кремний взаимодействует со смесью кислот азотной и фторводородной (плавиковой).
3Si + 12HF + 4HNO3 = 3SiF4 ↑ + 4NO ↑ + 8H2O
Водные растворы щелочей растворяют кремний с образованием растворимых солей кремниевой кислоты – силикатов:
Si + 2NaOH + H2O = Na2SiO3 + 2H2 ↑
Как окислитель кремний выступает в реакции с металлами:
| +2 –1 | |||
| Si0 + 2Mg0 | = | Mg2Si | (силицид магния) |
Способы получения кремния.
1. Ядерная реакция: 24Mg + 4He → 28Si + γ (лучи)
2. Горение кислорода при температуре около 10-9К
16O + 16O → 28Si + 4He
3. Восстановлением фторида кремния из кремнефторидов или щелочными металлами K, Na
SiF4 + 4K = 4KF + Si
K2SiF6 + 4K = 6KF + Si
4. Восстановлением горного хрусталя металлическим магнием при высоких температурах
SiO2 + 2Mg → 2MgO + Si + тепло Q
5. Восстановлением кремнезема углеродом или карбидом
| t0 19000C | ||
| SiO2 + 2C | = | Si + 2CO |
| SiO2 + 2SiC | = | 3Si + 2CO |
6. Термическим разложением силанов при температуре 780-8000С
| t0 | ||
| SiH4 | → | Si + 2H2 ↑ |
7. Восстановлением из тетрахлорида кремния металлическим цинком:
| t0 10000 | ||
| SiCl4 + 2Zn | = | 2ZnCl2 + Si |
или водородом
| SiCl4 + 2H2 | = | Si + 4HCl |
8. Восстановлением из солей кремнефтористоводородных кислот алюминием (алюмотерапия)
3K2SiF6 + 4Al = 3Si + 6KF + 4AlF3
Применение кремния.
1. Для производства силитовых (корундовых) стержней для электронагревательных печей с Т0 14000С
2. В качестве восстановителя металлического бария
3BaO + Si = 2Ba + BaSiO3
3. Для производства полупроводников (в радио, электронике, телемеханике, фотоэлементов и т.д.)
4. Для производства различных сплавов (ферросплав) силицидов
5. Для производства кислотоупорных материалов, расплавов
6. Для раскисления чугунов, сталей, повышения их прочности.
В результате изучения данной темы студент должен:
Знать, что такое кремний, его химический знак, агрегатное состояние, виды, свойства физические и химические, способы производства, применение, распространение в природе, соединения на его основе.
Уметь написать химическую формулу, назвать его, написать химические реакции, определяющие способы его получения, его химические свойства, выполнить расчеты на основе получения кремния из его соединений.
Вопросы для самоконтроля по теме 1.
1. Дайте определение кремния. Его формула, название, расположение в таблице элементов Д.И.Менделеева, его виды.
2. Как встречается кремний в природе, в каком виде? Наиболее известные минералы или горные породы.
3. В чем проявляется биологическая цикличность кремния?
4. Физические и химические свойства кремния. Реакции.
5. Основные способы производства кремния.
6. Понятие ферросплав (ферросилиций).
7. Применение кремния.
Расчеты и цепочка превращений на базе кремния, его соединений: образец.
Задача. Какое количество вещества – кремния Si содержится в образце массой 56г?
Решение: Определим молярную массу кремния по таблице элементов Д.И.Менделеева.
МSi = 28г/моль.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|