
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ОПЫТ 1.приготовление раствора хлорида натрия с заданной массовой долей соли (%) разбавлением концентрированного раствора.
Как известно, плотность - это масса вещества в единице объема, ρ = m/v. Зная плотность, можно по таблице определить массовую долю (%) раствора.
Определить плотность раствора можно многими способами. Из них наиболее простой и быстрый – с помощью ареометра (рис.3).
Его применение основано на том, что плавающее тело погружается в жидкость до тех пор, пока масса вытесненной им жидкости не станет, равна массе самого тела (закон Архимеда). В расширенной нижней части ареометра помещен груз, на узкой верхней части – шейке - нанесены деления, указывающие плотность жидкости, в которой плавает ареометр. Концентрацию исследуемого раствора находят, пользуясь табличными данными о плотности в зависимости от концентрации раствора. Плотность водных растворов хлорида натрия приведена в табл.1.
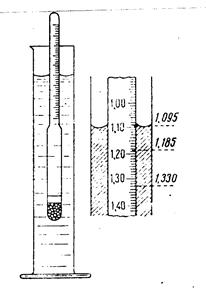
Рис. 3 Ареометр и отсчет по его шкале
Выполнение опыта.В мерный цилиндр наливают раствор хлорида натрия и ареометром определяют его плотность. По таблице 1 находят концентрацию исходного раствора [ в % ( масс) ].
Таблица 1.
Плотность и процентное содержание растворов хлорида натрия.
| Концентрация, %
| Плотность*10-3, кг/м3, при температуре | Концентра-ция, %
| Плотность*10-3, кг/м3, при температуре | ||
| 100С | 200С | 100С | 200С | ||
| 1,0071 | 1,0053 | 1,1049 | 1,1008 | ||
| 1,0144 | 1,0125 | 1,1127 | 1,1065 | ||
| 1,0218 | 1,0196 | 1,1206 | 1,1162 | ||
| 1,0292 | 1,0268 | 1,1285 | 1,1241 | ||
| 1,0366 | 1,0340 | 1,1364 | 1,1319 | ||
| 1,0441 | 1,0413 | 1,1445 | 1,1398 | ||
| 1,0516 | 1,0486 | 1,1525 | 1,1478 | ||
| 1,0591 | 1,0559 | 1,1607 | 1,1559 | ||
| 1,0666 | 1,0633 | 1,1689 | 1,1639 | ||
| 1,0742 | 1,0707 | 1,1772 | 1,1722 | ||
| 1,0819 | 1,0782 | 1,1856 | 1,1804 | ||
| 1,0895 | 1,0857 | 1,1940 | 1,1888 | ||
| 1,0972 | 1,0933 | 1,2025 | 1,1972 | ||
Рассчитывают, сколько миллилитров исходного раствора и воды следует взять для приготовления 250 мл 5% раствора. Воду отмерить цилиндром и вылить в мерную колбу объемом 250мл. Исходный раствор поваренной соли отмеряют цилиндром на 100 мл и вливают в колбу с водой. Раствор в колбе перемешивают. Цилиндр ополаскивают небольшим объемом раствора из колбы, который затем присоединяют к общей массе раствора в колбе. Проверить плотность и концентрацию полученного раствора. Рассчитать относительную ошибку δотн
δотн = 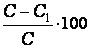 %,
%,
где С – заданная концентрация,
С1- полученная концентрация.
Сделайте расчет молярной концентрации молярной концентрации эквивалентов и титра, приготовленного раствора. Результаты запишите в таблицу 2.
Таблица 2.
Опытные данные
| Заданная массовая доля, (%) | Плотность,ρ, кг/м3 | Рассчитанные массы компонентов, г | Плотность экспериментальная, ρ, кг/м3 | Экспериментальные концентрации | δотн | |||||
| NaCl | H2O | |||||||||
| с, % | с, М | сэк, н | T, г/мл | |||||||
ПРИМЕР 1.Приготовить 0,5 л 20% раствора H2SO4, исходя из концентрированного раствора, плотность которого 1,84 г/см3.
По таблице находим, что плотности 1,84 г/см3 соответствует кислота с содержанием 96% H2SO4, а 20% раствору соответствует кислота с плотностью 1,14 г/см3.
Вычислим количества исходной кислоты и воды, требующиеся для получения заданного объема раствора.
Масса его составляет 500 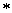 1,14 = 570 г, а содержание в нем H2SO4 равно
1,14 = 570 г, а содержание в нем H2SO4 равно
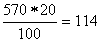 г.
г.
Вычислим, в каком объеме исходной 96% кислоты содержится 114 г H2SO4:
1 мл исходной кислоты содержит 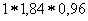 г H2SO4
г H2SO4
 х мл исходной кислоты содержит 114 г H2SO4
х мл исходной кислоты содержит 114 г H2SO4
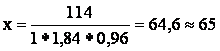 мл
мл
Таким образом, для приготовления 500мл 20% раствора H2SO4 необходимо взять 64,6 мл 96% раствора.
Количество воды определяется как разность весов полученного исходного раствора, а именно 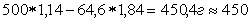 мл
мл
ОПЫТ 2. приготовление раствора заданной концентрации смешиванием растворов более высокой и более низкой концентрации.
Раствор можно готовить, непосредственно вводя рассчитанное количество вещества в растворитель, или путем разбавления более концентрированных растворов до требуемого значения концентрации.
ПРИМЕР 2. Приготовить 100г 36% раствора H3PO4, смешав 44% и 24% растворы этой кислоты.
I СПОСОБ РАСЧЕТА:
Обозначим через х количество граммов 44% раствора, которое следует добавить к (100-х) граммам 24% раствора для получения 100г 36% раствора H3PO4. Составим уравнение:
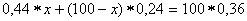
откуда 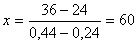
Следовательно, необходимо взять 60г 44% раствора  и 100 - х = 40г 24% раствора.
и 100 - х = 40г 24% раствора.
II СПОСОБ РАСЧЕТА:
Он называется "правилом креста". Если в левый угол воображаемого прямоугольника поместить более высокую концентрацию – 44, а в нижний левый – меньшую концентрацию –24, а в центре - концентрацию получаемого смешанного раствора – 36 и затем вычесть по диагонали из большего числа меньшее, то отношение разностей 12 : 8 = 3 : 2 покажет в каком весовом соотношении следует смешать исходные растворы для получения раствора заданной концентрации.
Так, для получения 100г 36% раствора достаточно смешать 60г 44% раствора и 40 г 24% раствора.

Определив по таблице плотности исходных растворов – 1,285 г/см3 (для 24% раствора) находим, что объемы их соответственно составляют:
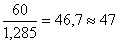 мл 44% раствора H3PO4
мл 44% раствора H3PO4
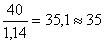 мл 24% раствора H3PO4
мл 24% раствора H3PO4
В общей форме "правило креста" имеет вид:
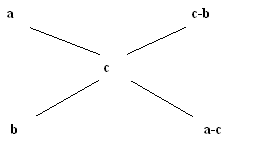
где а и в соответственно большая и меньшая исходные концентрации;
с - концентрация смешанного раствора;
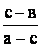 - показывает, в каком массовом соотношении следует смешать исходные растворы.
- показывает, в каком массовом соотношении следует смешать исходные растворы.
Выполнение опыта.Приготовить 250 мл 10 % раствора хлорида натрия, имея в своем распоряжении 15 % и 5 % раствор NaCl.
Учитывая плотности приготовляемого и исходных растворов рассчитать объемы 15 % и 5 % раствора (см. пример 2). Отмерить вычисленные объемы исходных растворов, слить в колбу на 250 мл, закрыть колбу пробкой и тщательно перемешать раствор, перевернув колбу несколько раз вверх дном. Отлить часть раствора в цилиндр, измерить ареометром плотность приготовленного раствора и по табл.1 найти его концентрацию (в %). Установить расхождение практически полученной концентрации с заданной. Рассчитать относительную ошибку δотн.
ОПЫТ 3. приготовление водного раствора хлорида натрия. определение массовой доли и расчет навески.
Получить навеску соли хлорида натрия у преподавателя. При помощи воронки перенести данную навеску в мерную колбу емкостью 250 мл. Промывалкой обмыть внутреннюю часть воронки небольшим количеством воды. Растворить соль в воде. Затем, добавляя воду небольшими порциями, довести уровень воды в колбе до метки, закрыть колбу пробкой и тщательно перемешать, переворачивая вверх дном. Замерить плотность полученного раствора ареометром. Для этого раствор перелить в мерный цилиндр. Уровень жидкости должен быть ниже края цилиндра на 3-4 см. Осторожно опустите ареометр в раствор. Ареометр не должен касаться стенок цилиндра. Отсчет плотности по уровню жидкости производите сверху вниз. По таблице 1 найдите и запишите массовую долю (в %) раствора, отвечающую этой плотности. Рассчитать количество хлорида натрия взятого для приготовления 250 мл раствора.
ПРИМЕР. Пусть плотность приготовленного раствора хлорида натрия ρ=1,0053г/см3 . Это соответствует 1% концентрации раствора. Следовательно, в100г раствора содержится 1г NaCl. Определим массу 250 мл раствора
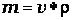 =
= 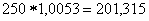
Исходя из того, что в 100г раствора содержится 1г NaCl, узнаем, сколько грамм NaCl содержится в 201,315г раствора:
100 г раствора - 1 г NaCl
201,315 г раствора - х г NaCl
х = 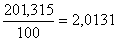 г NaCl
г NaCl
Таким образом, была взята навеска NaCl массой 2,0131 г.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|