
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Дата 17.04.2020 химия 9
Дата 17.04.2020 химия 9
Тема: Электроотрицательность. Степень окисления. Строение вещества.
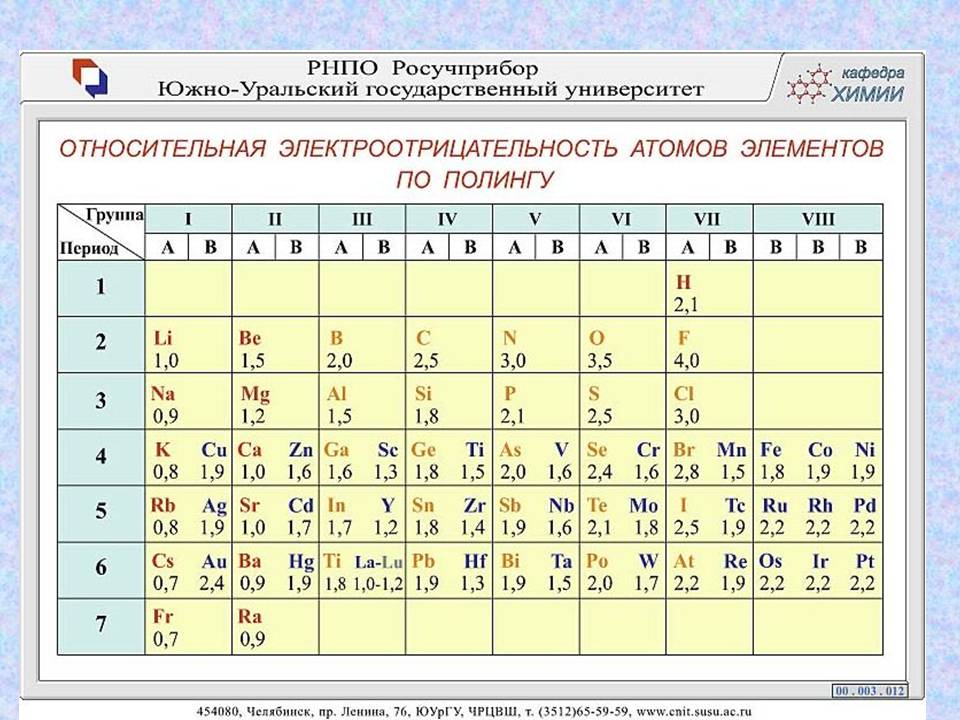
Электроотрицательность – свойство атомов химического элемента притягивать на себя электроны от атомов других элементов в соединениях.
За единицу ЭО принимается ЭО лития (1.0). Наибольшее значение ЭО имеет элемент фтор (4.0). Зная положение элемента в ПСХЭ и численное значение ЭО, можно судить о принадлежности элемента к металлам и неметаллам. У металлов – ЭО меньше 2. В периодах ЭО возрастает слева направо, а в главных подгруппах – снизу вверх.
Увеличение ЭО и ослабление металлических свойств в периодах объясняются увеличением числа валентных электронов и стремлением атома дополнить свою электронную конфигурацию до конфигурации инертного газа.
Уменьшение ЭО и увеличение металлических свойств в группах объясняются увеличением радиуса атома и уменьшением притяжения валентных электронов.
Типы химической связи:
1. Ковалентная неполярная – одинаковая ЭО.
2. Ковалентная полярная – ЭО различается незначительно. HCl, Na2SO4. Обменный и донорно-акцепторный механизмы.
3. Ионная – ЭО отличается значительно (между атомами типичных Ме и неметаллов). NaCl, Na2SO4.
4. Металлическая.
5. Водородная – между H и элементом с большой ЭО.
| Виды химической связи | ||||
| Вид связи | Тип связываемых элементов | Вид связываемых частиц | Механизм образования связи | Примеры веществ |
| Ионная | Металл - неметалл | Ионы | Переход электронов от атомов металлов к атомам неметаллов | NaCl, CaF2, Li2O |
| Ковалентная неполярная | Один и тот же элемент-неметалл | Атомы | Образование общих электронных пар | H2, F2, O2, N2 |
| Ковалентная полярная | Разные неметаллы | Атомы | Образование общих электронных пар со смещением их в сторону атомов более электроорицательного элемента | HCl, OF2, CO2 |
| Металлическая | Металлы | Атом-ионы | Обобществление внешних электронов | Металлы и сплавы |
Гибридизация и пространственное строение: тетраэдр, пирамида, треугольник. CH4, NH3, H2O.
Степень окисления – условный заряд атома в химическом соединении, если предположить, что все связи в соединении ионные.

Задания по теме
Упражнения по закреплению знаний о степенях окисления
- Назовите оксиды азота NO, NO2, N2O3
- Дайте названия хлоридам: PCl3, FeCl2
- Определите степени окисления: H2S, H2SO3, S, N2O5
- Составьте формулы соединений, состоящие из а) серы и водорода, б) хлора и бария
5.Составьте формулы веществ по названию: а) сульфид натрия, б) оксид фосфора (V), в) оксид алюминия
6. Определите вид связи для веществ с формулами. K, F2, KF, PF3
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|