
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Лекция 22. Катализ и катализаторы. Что такое катализатор и каталитические реакции?. Виды катализа.. Механизм действия катализаторов.. Значение катализа?. Что такое катализатор и каталитические реакции?. Виды катализа
Лекция 22
Катализ и катализаторы
План:
1. Что такое катализатор и каталитические реакции?
2. Виды катализа.
3. Механизм действия катализаторов.
4. Значение катализа?
Что такое катализатор и каталитические реакции?
Одним из наиболее распространённых в химической практике методов ускорения химических реакций является катализ.
Катализ (от греч. сatalysis – разрушение) – изменение скорости химической реакции при воздействии веществ (катализаторов или ингибиторов), которые участвуют в реакции, но не входят в состав продуктов.
Катализаторы – вещества, повышающие скорость химических реакций, но состав и количество которых в конце реакции остаётся неизменным.
Ингибиторы – вещества, замедляющие скорость химических реакций, но состав и количество которых в конце реакции остаётся неизменным.
Виды катализа
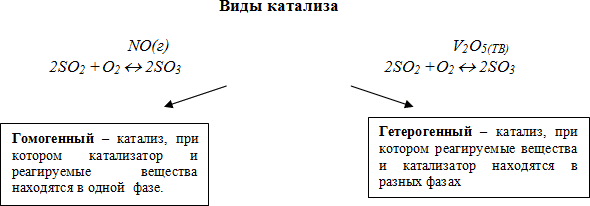
(если нет возможности провести демонстрацию опытов, то на слайде есть видеоролики с данными опытами)
Примером гомогенного катализа может служить взаимодействие пероксида водорода с сульфатом тетраамминмеди (II).

Демонстрация опыта:
В химический стакан добавляем несколько капель жидкого мыла, далее добавляем 2 мл раствора комплексной соли, а затем приливаем пероксид водорода. Наблюдаем реакцию вспенивания жидкого мыла.
Примером гетерогенного катализа является каталитическое окисление аммиака кислородом воздуха в присутствии оксида хрома (III).
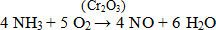
Демонстрация опыта:
В химическую колбу ёмкостью 500 мл помещаем раствор аммиака и закрываем пробкой. На спиртовке нагреваем дихромат аммония, затем помещаем в колбу с аммиаком. Наблюдаем реакцию «звёздный дождь».
Механизм действия катализатора:
Современные представления о катализе сводятся к следующему (разумеется, в самом упрощенном варианте). Есть исходные вещества, атомы, образующие исходные молекулы, можно представить так, что в продукте они будут связаны между собой иными, даже более прочными связями. Т.е. внутренняя энергия системы, состоящей из атомов после «перестановки».
Химическая реакция превращения исходных реагентов в продукты могла бы пройти, но что-то мешает. При описании трехмерной энергетической картины каталитической реакции используют такие образы – «долина исходных веществ», «долина продуктов». Между ними – хребет, энергетический барьер. Он не подпускает атомы настолько близко друг к другу, чтобы они могли поменяться местами и образовать новые, более прочные связи. И перепрыгнуть просто так хребет не получается. А катализаторы оказываются теми самыми проводниками, которые позволяют найти необходимый путь – перевал с высотой поменьше. Там, на перевале катализатор образует промежуточный активированный комплекс, один сразу или несколько последовательно, и соединяет, в конце концов, атомы исходных веществ между собой в ином, нужном исследователям сочетании. Потом он позволяет молекулам новых соединений благополучно скатиться в долину продуктов, а сам удаляется, чтобы соединить новые пары, в идеале – оставшись неизменным. В реальности, правда, он оказывается, изрядно подпорчен каталитическими ядами и прочими невзгодами.
Существует ряд теорий, объясняющих механизм действия катализаторов. Для понимания механизма гомогенного катализа предложена теория промежуточных соединений.
Сущность этой теории заключается в том, что если медленно протекающую реакцию А + В → АВ вести в присутствии катализатора К, то катализатор вступает в химическое взаимодействие с одним из исходных веществ, образуя непрочное промежуточное соединение:
А + К → АК
Затем промежуточное соединение АК взаимодействует с другим исходным веществом, при этом катализатор освобождается:
АК + В → АВ +К
Если теперь оба процесса суммировать, то получим исходное уравнение:
А+В → АВ
Вывод: катализатор доставляет реагирующим частицам необходимую энергию для эффективных соударений, т.е. катализатор снижает необходимую для реакции энергию активации, предоставляя реагентам альтернативный путь разрушения и образования связей.
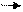 Действие катализаторов связано с тем, что они вступают в промежуточное взаимодействие с реагентами, направляя процесс на новый путь, характеризующийся более низким значением энергии активации (см. рис.).
Действие катализаторов связано с тем, что они вступают в промежуточное взаимодействие с реагентами, направляя процесс на новый путь, характеризующийся более низким значением энергии активации (см. рис.).
Еа – энергия активации прямой реакции без катализатора;
 Еа – энергия активации обратной реакции без катализатора;
Еа – энергия активации обратной реакции без катализатора;
∆Ек – понижение энергии активации реакции с катализатором.
Катализаторы обладают определёнными свойствами:
1. Катализаторы не создают процесса, а только изменяют его скорость;
2. Для обратимых реакций катализаторы не смещают равновесие и не влияют на константу равновесия, а лишь ускоряют процесс достижения равновесного состояния;
3. Катализатор снижает необходимую для реакции энергию активации, предоставляя реагентам альтернативный путь разрушения и образования связей;
4. Катализаторы обладают избирательностью, т.е. ускоряют только одну из нескольких реакций.
Избирательность катализаторов мы можем пронаблюдать на следующем примере.
| Реагенты | Катализаторы | Продукты |
| СО + Н2 | Со, Ni, Ru | Алканы (преимущественно) |
| Fe | Алкены (преимущественно) | |
| Zn∙CuO, ZnO∙CrO3 | Метанол | |
| ZnO∙CrO3+ щелочь | Высшие спирты | |
| Fe +BeO | Альдегиды и кетоны |
Строгая избирательность и высокая скорость – два основных признака ферментативного катализа, отличающие его от лабораторного и производственного катализа. Ни один из созданных руками человека катализаторов не может сравниться с ферментами по силе и избирательности воздействия на органические молекулы.
Ферменты отличаются особой специфичностью, каждый из них ускоряет только одну химическую реакцию с выходом 100%. Ингибиторы в живом организме подавляют различные вредные реакции окисления в клетках тканей, которые могут инициироваться радиоактивным излучением.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|