
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Проведите реакции между парами веществ (Запишите в тетрадь)
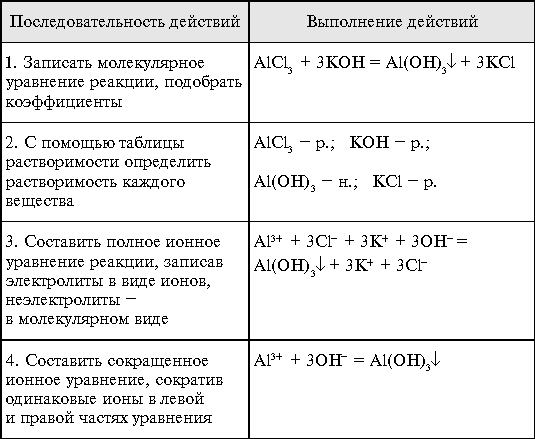
Тема: Ионные уравнения
Каждое химическое свойство, проявляемое сильными электролитами в растворах, - это свойство ионов, на которые электролит распался: либо катионов, либо анионов. Между тем, реакции обмена между электролитами в водных растворах мы раньше изображали молекулярными уравнениями, не учитывая, что в этих реакциях участвуют не молекулы электролита, а ионы, на которые он диссоциирован.
- Итак, реакции, осуществляемые в растворах между ионами, называются ионными, а уравнения таких реакций – ионными уравнениями.
Например:
При сливании растворов CuCl2 и AgNO3 мы наблюдаем выпадение осадка
2AgNO3 + CuCl2 = Cu(NO3)2 + 2AgCl
вещество выпадает в осадок - хлорид серебра
вещество остается в растворе -нитрат меди
Обе исходные соли – сильные электролиты, полностью диссоциирующие в воде. Запишем эти соли в ионном виде.
2Ag+ + 2NO3- + Cu2+ + 2Cl- = Cu2+ + 2NO3- + 2AgCl запись полного ионного уравнения
Ионы Ag+ и Cl- соединились и образовали AgCl, выпавший в осадок.
Ионы же Cu2+ и NO3- в реакции не участвовали, они остались такими, какими были и до сливания растворов, следовательно, мы можем исключить их обозначение из левой и правой частей полного ионного уравнения.
2Ag+ + 2Cl- = 2AgCl сокращенное ионное уравнение.
Задание. По таблице растворимости выберите любые другие электролиты, содержащие ионы Ag+ и Cl .
Таким образом, сокращенные ионные уравнения показывают сущность процесса, протекающего между растворами электролитов.
Проведите реакции между парами веществ (Запишите в тетрадь)
1. сульфат меди (II) и гидроксид кальция
2. карбонат натрия и соляная кислота
3. соляная кислота и гидроксид бария
Сформулируйте определение понятия «реакции ионного обмена» (реакции между ионами в растворах электролитов, протекающие с выделением осадка, газа или воды)
Если выделится газ – это раз,
Иль получится вода – это два,
А ещё нерастворимый
Осаждается продукт.
«Есть осадок», - говорим мы
Это третий важный пункт.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|