
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Примеры задач переписать в семинарских тетрадях, проработать, разобраться в решениях, подготовиться к будущему контролю.
Примеры задач переписать в семинарских тетрадях, проработать, разобраться в решениях, подготовиться к будущему контролю.
Лабораторная работа №3 (теорет.занятие)
Термодинамика
Примеры решения задач
Пример 1.Рассчитайте стандартную энтальпию реакции СН4(г) + 2O2(г) = СО2(г) + 2Н2О(ж), используя данные по стандартным энтальпиям образования веществ (таблица ).
Решение
Используя первое следствие из закона Гесса, получим
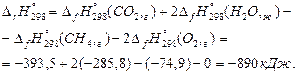
Стандартная энтальпия реакции меньше нуля, следовательно, данная реакция является экзотермической.
Пример 2. Реакция горения этана выражается термохимическим уравнением:
C2H6(Г) + 3,5O2(Г) = 2CO2(Г) + 3H2O(Ж), DH° = –1559,87кДж.
Вычислите теплоту образования этана, если известны теплоты образования CO2(Г) и H2O(Ж) (табл.).
Решение. Нужно вычислить тепловой эффект реакции, термохимическое уравнение которой имеет вид
2C(ГРАФИТ) + 3H2(Г) = C2H6(Г), DH ° =?
исходя из следующих данных:
а) C2H6(Г)+3,5 O2(Г) = 2 CO2(Г) + 3 H2O(Ж), DH° = –1559,87 кДж;
б) C(графит)+O2(Г) = CO2(Г), DH° = –393,51 кДж;
в) H2(Г) + 0,5O2(Г) = H2O(Ж), DH° = –285,84 кДж.
Закон Гесса позволяет обращаться с термохимическими уравнениями так же, как и с алгебраическими. Для получения результата следует уравнение (б) умножить на 2, уравнение (в) – на 3, а затем сумму этих уравнений вычесть из уравнения (а):
C2H6 + 3,5 O2 – 2C – 2O2 – 3H2 – 1,5O2 = 2CO2 + 3H2O – 2CO2 –3H2O;
DrH° = –1559,87 – 2(–393,51) – 3(–285,84) = 84,67 кДж;
C2H6(Г) = 2C(графит) + 2H2(Г) , DH° =84,67 кДж.
Так как теплота образования вещества равна теплоте его разложения, взятой с обратным знаком, следовательно, DfH °(C2H6(Г))= –84,67 кДж/моль.
К аналогичному результату приходим, решая задачу с применением 1-го следствия из закона Гесса:
DrH° = [2моль×DfH°(CO2)+3 моль×DfH°(H2O)] – [1моль×DfH°(C2H6) + 3,5 моль×DfH°(O2)].
Учитывая, что энтальпии образования всех простых веществ в их стандартных состояниях принимают равными нулю, имеем
–1559,87 кДж = 2 моль× (–393,51) кДж/моль + 3 моль× (-285,84) кДж/моль – 1 моль× DfH°(C2H6) –3,5 моль× 0 кДж/моль.
Отсюда выражаем искомую величину DfH°(C2H6):
DfH°(C2H6) = –84,67 кДж /1 моль = –84,67 кДж/моль.
Пример 3. Определите количество теплоты, выделяющееся при взаимодействии 100 кг извести СаО с водой, используя данные по стандартным энтальпиям образования веществ (таблица ).
Решение
Реакция выражается уравнением: СаО(кр) + Н2О(ж) = Са(ОН)2(кр).
Тепловой эффект реакции равен
DrH° =DfH°(Са(ОН)2) -DfH°( СаО) -DfH°( Н2 О)=-986,2+635,1+285,4= 65,3 кДж/моль.
Тепловой эффект реакции рассчитан на один моль извести СаО, т.е. на 56 г СаО.
Количество теплоты, выделяющееся при взаимодействии 100 кг извести с водой найдем из пропорции
56 г СаО – (-65,3) кДж
100000 г СаО – х.
Следовательно, х = -1,16·105 кДж.
Пример 4. Не производя вычислений, определите знак изменения энтропии в следующих реакциях:
1) NH4NO3(К) = N2O(Г) + 2H2O(Г);
2) 2H2(Г) +O2(Г) = 2H2O(Г);
3) 2H2(Г) + О2(Г) = 2H2O(Ж).
Решение.В реакции (1) 1 моль NH4NO3 в кристаллическом состоянии образует 3 моль газов, следовательно, DrS1>0.
В реакциях (2) и (3) уменьшается как общее число молей, так и число молей газообразных веществ. Следовательно, DrS2<0 и DrS3<0. При этом DrS3 < DrS2, т.к. SH2O(Ж) < SH2O(Г).
Пример 5. Вычислите изменение энтропии для следующей реакции при стандартной температуре:
2С(графит) + 3Н2(Г) = С2Н6(Г).
Решение.Из табл. находим:
S°(С(ГРАФИТ)) = 5,69 Дж/(моль×К);
S°(H2) = 130,59 Дж/(моль×К);
S°((C2H6)(Г) )= 229,5 Дж/(моль×К).
Изменение энтропии химической реакции:
DrS° = å S°ПРОД – å S°ИСХ ;
DrS° = 1 моль × 229,5 Дж/(моль×К) – [ 2 моль × 5,69 Дж/(моль×К) + 3 моль×130,59 Дж/(моль×К)]=–173,65 Дж/К.
Индекс температуры (298 К) при записи энтропии S°(298 K)(В) и DrS°(298 K) допускается не указывать.
Пример 6. Прямая или обратная реакция будет протекать при стандартных условиях в системе
 CH4(Г) + CO2(Г) 2CO(Г) + 2H2(Г)?
CH4(Г) + CO2(Г) 2CO(Г) + 2H2(Г)?
Решение.Для ответа на вопрос следует вычислить DrG°(298 K) для прямой реакции. Зная, что DG есть функция состояния и что DfG°(298 K) для простых веществ, находящихся в устойчивых (базовых) состояниях, равны нулю, находим DrG°(298 K) процесса:
DrG°(298 K) = å DfG°(298 K)ПРОД – å DfG°(298 K)ИСХ;
DrG°(298 K) = [2 моль × (–137,27) кДж/моль+ 2 моль × 0кДж/моль] – [1 моль × (–50,79) кДж/моль + 1 моль × (–394,38) кДж/моль]= 170,63 кДж.
Так как DrG°(298 K)>0, то самопроизвольное протекание прямой реакции при стандартных условиях невозможно.
Пример 7. Будут ли реакции
 1)Cl2(Г) + 2HI(Г) I2(К) + 2HCl(г),
1)Cl2(Г) + 2HI(Г) I2(К) + 2HCl(г),
 2) I2(К) + H2S(Г) 2HI(Г) + S(К)
2) I2(К) + H2S(Г) 2HI(Г) + S(К)
самопроизвольно протекать в прямом направлении при температуре 298 К?
Решение.Рассчитываем значение DrG°(298K) рассматриваемых реакций. Из табл. находим:
DfG°(298 K) (HCl) = –95,2 кДж/моль;
DfG°(298 K) (HI) = 1,8 кДж/моль;
DfG°(298 K) (H2S) = –33,8 кДж/моль .
Отсюда для реакций (1) и (2) соответственно
DrG°(298 K) = 2 моль × (–95,2) кДж/моль – 2 моль ×
1,8 кДж/моль = –194,0 кДж;
DrG°(298 K) = 2 моль × 1,8 кДж/моль – 1 моль ×
(–33,8) кДж/моль= =37,4 кДж.
Отрицательное значение DrG°(298 K)1 указывает на возможность самопроизвольного протекания реакции (1), а положительное DrG°(298 K)2 означает, что реакция (2) в указанных условиях протекать не может.
Пример 8. Вычислить стандартное изменение свободной энергии Гиббса при температуре 298,15 К для реакции
NH3(Г) + HCl(Г) = NH4Cl(К)
на основании стандартных значений DfH°(298 K) и S°(298 K) (табл.).
Решение. Определяем DrH°:
DrH° = å DfH°ПРОД - å DfH°ИСХ ;
DrH° = 1 моль × (-315,39) кДж/моль - [1 моль × (-46,19) кДж/моль +
+1 моль × (-92,31) кДж/моль] = -176,89 кДж
(реакция экзотермическая).
Находим изменение энтропии реакции:
DrS° = 1 моль × 94,5 Дж/(моль×К) - [ 1 моль ×
192,5 Дж/(моль×К) +1 моль × 186,68 Дж/(моль×К)] =
= -284,68 Дж/К.
Затем находим изменения свободной энергии Гиббса:
DrG° (Т) = DrH° – ТDrS°;
DrG°(298 K) = –176,89кДж + 298,15 К × 284,68×10–3 кДж/К = –92,01 кДж.
Так как DrG°(298 K)<0 , то данная реакция термодинамически возможна.
Пример 9. Реакция восстановления Fe2 O3 водородом протекает по уравнению Fe2 O3 (к) + 3Н2 (г) = 2 Fe (к) + 3Н2 О (г); DrH°= + 96, 61 кДж.
Возможна ли эта реакция при стандартных условиях, если изменение энтропии DrS= 0,1387 кДж/(моль×К)? При какой температуре начнётся восстановление Fe2 O3?
Решение. Вычисляем DrG°: DrG° = DrH° – ТDrS°= =96,61-298 × 0,1387 = +55,28 кДж.
Так как DrG°>0 , то реакция при стандартных условиях невозможна; наоборот, при этих условиях идёт обратная реакция окисления железа (коррозия). Найдём температуру, при которой
DrG°= 0: DrH°= ТDrS; Т=DrH°/ DrS°= 96,61 : 0,1387=686,5 К.
Следовательно, при температуре, равной 696,5 К, начнётся реакция восстановления Fe2O3. Иногда эту температуру называют температурой начала реакции.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|