
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Хронометраж проведения занятия
Хронометраж проведения занятия
| № | Этапы занятия | Время (мин.) |
| Исходный контроль знаний по теме лабораторного занятия (устно) | ||
| Проверка готовности к выполнению лабораторной работы, согласно рабочих мест | ||
| Выполнение лабораторной работы | ||
| Написание протокола | ||
| Защита протокола | ||
| Контроль знаний по теме лабораторного занятия (тестирование) | ||
| Подведение итогов (выставление оценок) |
| РАБОЧЕЕ МЕСТО №1 | Провести полный фармакопейный анализ бромгексина гидрохлорида в таблетках по статье ГФ РК, II том, стр. 615 |
| РАБОЧЕЕ МЕСТО №2 | Провести полный фармакопейный анализ фуросемида в таблетках по статье ГФ РК, II том, стр. 666 |
| РАБОЧЕЕ МЕСТО №3 | Провести полный фармакопейный анализ хлорамфеникола в таблетках по статье ГФ РК, II том, стр. 671 |
| РАБОЧЕЕ МЕСТО №4 | Провести полный фармакопейный анализ нитроксолина в таблетках по НД РК 42 -0076-98 |
| РАБОЧЕЕ МЕСТО №5 | Провести полный фармакопейный анализ фурадонина в таблетках по НД РК 42-0053-97 |
| РАБОЧЕЕ МЕСТО №6 | Провести полный фармакопейный анализ Амброксола гидрохлорида в таблетках по статье ГФ РК, II том, стр. 600 |
Литература
на русском языке
основная:
1. Арзамасцев А.П.. Фармацевтическая химия: учебное пособие, 3-е изд., испр.-М.:ГЭОТАР-Медиа.-2006.-640с.
2. Арыстанова Т.А. Общая фармацевтическая химия/Учебное пособие.-Алматы: Эверо.-2013.-238с.
3. Арыстанова Т.А. Фармацевтическая химия, том I: - Алматы, изд. «Эверо».-2015.-238с.
4. Арыстанова Т.А. Фармацевтическая химия, том II: - Алматы, изд. «Эверо».-2015.-640с.
5. Беликов В.Г. Фармацевтическая химия. В 2-х ч: учебное пособие, 4-е изд., перераб. и доп.-М.: МЕДпресс-информ.-2007.- 624с.
6. Государственная фармакопея Республики Казахстан.-Алматы: Издательский дом «Жибек жолы».-2008.-Том 1.- 592с.
7. Государственная фармакопея Республики Казахстан.- Алматы: Издательский дом «Жибек жолы».-2009.-Том 2.- 804с.
8. Государственная фармакопея Республики Казахстан.-Алматы: Издательский дом «Жибек жолы».-2014.-Том 3.-729с.
9. Ордабаева С.К. Анализ лекарственных препаратов, производных ароматических соединений.-2012.-770 с.
10. Раменская Г.В. Фармацевтическая химия: учебник – М.:БИНОМ. Лаборатория знаний,2015.-467с.
11. British Pharmacopoeia (BР 2016).-London The Stationery Office,2016.
12. European Pharmacopoeia 8.4.EDQM.2015.
13. Japanese Pharmacopoeia, 16th edition, 2013 г.
14. International Pharmacopoeia. 5th ed. – Geneva: WHO, 2015.
15. The United States Pharmacopeia 38 – National Formulary 33, Reissue 2015.
дополнительная:
1. Арыстанова Т.А., Арыстанов Ж.М. Инновационные технологии в фармацевтическом образовании: обучение и контроль. Учебно-методическое пособие. – Шымкент,2012.- 175с.
2. Ордабаева С.К., Надирова С.Н. Унифицированные методики хроматографического анализа лекарственных форм метронидазола (научно-методические рекомендации).- Шымкент:изд.«Әлем».2015.-84с.
3. Ордабаева С.К. Теоретическое и экспериментальное обоснование создания и стандартизации лекарственных препаратов глицирризинововй кислоты (Диссертация нак соискание степени доктора фармацевтических наук).-Шымкент,2006.-231 с.
4. Georgiyants V.A., Bezugly P.O., Buriaqn G.O., Abu Sharkh A.I., Taran K.A. Pharmaceutical chemistre. Lectures for End lish- speaking students: Ph 24 the study guide for students of fhigher schools-Khark iv: NUPh Original, 2013.-527 p.
на казахском языке*
1. Арыстанова Т.А. Жалпы фармацевтикалық химия. Оқу құралы.-Алматы: Эверо.-2013.-286 б.
2. Қазақстан Республикасының Мемлекеттік фармакопеясы.-Алматы: «Жібек жолы» баспа үйі.-2008.-1 Т.-592б.
3. Қазақстан Республикасының Мемлекеттік фармакопеясы.-Алматы: «Жібек жолы» баспа үйі.-2009.-2 Т.-804б.
4. Қазақстан Республикасының Мемлекеттік фармакопеясы.-Алматы: «Жібек жолы» баспа үйі.-2014.-3 Т.-709б.
5. Ордабаева С.К., Каракулова А.Ш. Глицирризин қышқылы тундыларының дәрілік препараттарының бірыңғайланған сапасын бақылау әдістемелерін жасау (Ғылыми-әдістемелік нұскау).-Шымкент, 2013.-92 б.
Контроль:
1. Общая характеристика таблетированных лекарственных форм.
2. Нормативные документы по контролю качества таблетированных лекарственных средств.
3. Требования, предъявляемые к таблеткам.
4. Спецификации качества таблетированных лекарственных средств.
5. Как проводятся испытания таблеток в в соответствии с требованиями ГФ РК по разделам НД:
- описание.
- идентификация;
- средняя масса и однородность массы;
- однородность содержания;
- истираемость,
- устойчивость к раздавливанию;
- распадаемость;
- растворение;
- тальк и аэросил;
- потеря в массе при высушивании или вода;
- родственные примеси;
- остаточные количество органических растворителей (при их
использовании в технологии);
- микробиологическая чистота;
- количественное определение.
6. Какие основные разделы включают НД на таблетки?
7. Какой раздел НД регламентирует время полного распада таблетки?
8. Какие требования, предъявляются к разделу НД «Степень диспергирования» на таблетки.
9. В какой последовательности излагается раздел НД «Истираемость» на таблетки?
10. Какие требования, предъявляются к разделу НД «родственные примеси» на таблетки.
11. Какие выражения используются для указания температурного режима хранения при составлении НД на таблетки?
12. Какие требования, предъявляются к разделу НД «Потеря в массе при высушивании»?
13. Какой раздел НД нормирует период времени до даты следующего контроля на таблетки?
14. В какой последовательности излагается раздел НД «Хранение» на таблетки?
15. Какие характеристики регламентированы в разделе НД «Количественное определение» на таблетки?
16. В соответствии с требованиями ГФ РК допустимые нормы отклонения таблеток весом 80 мг и менее от средней массы составляют не более … .
А) 10%
Б) 20%
В) 5%
Г) 4%
Д) 2%
17. В соответствии с требованиями ГФ РК допустимые нормы отклонения таблеток весом более 80 мг, но менее 250 мг от средней массы составляют не более … .
А) 7,5%
Б) 20%
В) 5%
Г) 4%
Д) 2%
18. В соответствии с требованиями ГФ РК допустимые нормы отклонения таблеток весом 250 мг и более от средней массы составляют не более … .
А) 5%
Б) 20%
В) 7,5%
Г) 4%
Д) 2%
19. Скользящие и смазывающие вещества при приготовлении таблеток применяют для … .
А) улучшения текучести и уменьшения прилипания
Б) улучшения текучести
В) уменьшения прилипания
Г) улучшения распадаемости
Д) улучшения сыпучести
20. В соответствии с требованиями ГФ РК при отсутствии других указаний в частной статье для определения средней массы таблеток допускаются нормы отклонения … .
А) 5%
Б) 7%
В) 10%
Г) 3%
Д) 15%
21. В соответствии с требованиями ГФ РК диспергируемые таблетки должны распадаться в течение … мин.
А) 3
Б) 5
В) 1
Г) 4
Д) 10
22. В соответствии с требованиями ГФ РК для определения истираемости таблеток без оболочки массой менее 0,65 г берут … .
А) 20
Б) 5
В) 10
Г) 4
Д) 10
23. В соответствии с требованиями ГФ РК распадаемость таблеток определяют при температуре … .
А) 15ºС до 25ºС
Б) 5ºС до 15ºС
В) 1ºС до 10ºС
Г) 5ºС до 14ºС
Д) 9ºС до 13ºС
24. В соответствии с требованиями ГФ РК за 45 мин при определении теста «Растворения» для таблеток … действующего вещества должно перейти в раствор.
А) не менее 75%
Б) не менее 85%
В) не менее 95%
Г)не менее 65%
Д) не менее 90%
25. В соответствии с требованиями ГФ РК для определения распадаемости таблеток и капсул длиной не более 18 мм используют … .
|корзину с шестью циллиндрами
|корзину с тремя циллиндрами
|перфорированные диски, помещенные в стакан с водой
|проточный прибор
|прибор с лопастью мешалкой
26. В соответствии с требованиями ГФ РК для определения распадаемости таблеток и капсул длиной более 18 мм используют … .
|корзину с тремя циллиндрами
|корзину с шестью циллиндрами
|перфорированные диски, помещенные в стакан с водой
|проточный прибор
|прибор с лопастью мешалкой
27. В соответствии с требованиями РФ РК таблетки или капсулы считают распавшимися, когда на сетке … .
|нет остатка
|есть остаток, имеющий мелкое твердое ядро
|есть остаток, имеющий плотное несмачиваемое ядро
|есть фрагменты покрытия с ощутимым ядром
|есть деформированные остатки
28. В соответствии с требованиями ГФ РК, температура жидкости при испытаниях на распадаемость таблеток от … .
|35 º до 39 º С
|20 º до 25 º С
|18 º до 25 º С
|0 º до 10 º С
|комнатной до 35 ºС
29. В соответствии с требованиями ГФ РК, на приборе, представленном ниже, определяют … .
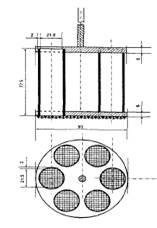
|распадаемость таблеток и капсул длиной не более 18 мм
|распадаемость таблеток и капсул длиной более 18 мм
|распадаемость суппозиториев
|скорость растворения активных ингредиентов твердых дозированных форм
|однородность массы для единицы дозированного лекарственного средства
30. В соответствии с требованиями ГФ РК, на приборе, представленном ниже, определяют … .
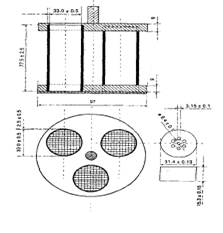
|распадаемость таблеток и капсул длиной более 18 мм
|распадаемость таблеток и капсул длиной не более 18 мм
|распадаемость суппозиториев
|скорость растворения активных ингредиентов твердых дозированных форм
|однородность массы для единицы дозированного лекарственного средства
31. В соответствии с требованиями ГФ РК на приборе, представленном ниже, определяют … .
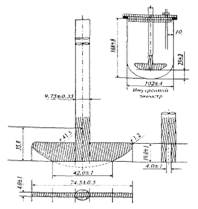
|скорость растворения активных ингредиентов твердых дозированных форм
|распадаемость суппозиториев, пессариев
|однородность массы для единицы дозированного лекарственного средства
|распадаемость таблеток и капсул
| микробиологическую чистоту
32. .В соответствии с требованиями ГФ РК на приборе, представленном ниже, определяют … .
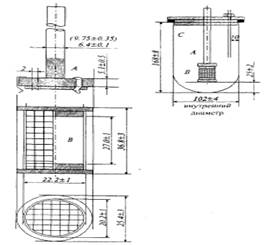
|скорость растворения активных ингредиентов твердых дозированных форм
|распадаемость суппозиториев, пессариев
|однородность массы для единицы дозированного лекарственного средства
|распадаемость таблеток и капсул
| микробиологическую чистоту
33. В соответствии с требованиями ГФ РК на приборе, представленном ниже, определяют … .

|скорость растворения активных ингредиентов твердых дозированных форм
|распадаемость суппозиториев, пессариев
|однородность массы для единицы дозированного лекарственного средства
|распадаемость таблеток и капсул
|количественное содержание для единицы дозированного лекарственного средства
34. В соответствии с требованиями ГФ РК в тесте «Растворение» для твердых дозированных форм среда растворения нагрета до … .
|37±0,5ºС
|комнатной температуры
|75 ºС - 85ºС
|10±0,5ºС
|25±0,5ºС
35. В соответствии с требованиями ГФ РК, проточный прибор предназначен для определения … .
|скорости растворения активных ингредиентов твердых дозированных форм
|распадаемости суппозиториев, пессариев
|однородности массы для единицы дозированного лекарственного средства
|распадаемости таблеток и капсул
|количественное содержание для единицы дозированного лекарственного средства
36. В соответствии с требованиями ГФ РК тест «Растворение» для твердых дозированных форм проводят на … .
|проточном приборе
|корзинках с шестью циллиндрами
|корзинках с тремя циллиндрами
|стеклянной пластинке
|воронке с виброустройством
37. В соответствии с требованиями ГФ РК под растворением твердых дозированных форм подразумевают … .
|количество действующего вещества, которое в стандартных условиях переходит в раствор из лекарственной формы
|деформацию лекарственной формы в растворе с сохранением мелкого твердого ядра
|разрушение лекарственной формы в растворе с образованием рыхлого остатка
|набухание лекарственной формы в растворе с сохранением плотного несмачиваемого ядра
|полный переход действующих веществ из лекарственной формы в раствор при стандартных условиях
38. В соответствии с требованиями ГФ РК при проведении теста «Растворение» для каждой единицы испытуемого препарата за 45 мин в раствор должно перейти …. действующего вещества от содержания, указанного в разделе частной статьи «Состав».
|не менее 75% и не более 115 %
|100%
|не менее 50% и не более 100 %
|не менее 25% и не более 100 %
|50%
39. В соответствии с требованиями ГФ РК испытания на однородность массы для единицы дозированного лекарственного средства проводят с … единицами дозированного средства.
|20
|10
|5
|6
|3
40. По методике ГФ РК «отбирают 20 единиц дозированного лекарственного средства, взвешивают каждую в отдельности, рассчитывают среднюю массу, отклонение от средней массы», определяют… для единицы дозированного лекарственного средства.
|однородность массы
|однородность содержания действующего вещества
|количественное содержание действующего вещества
|истираемость
|насыпной объем
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|