
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Реагент. Первая группа катионов. Вторая группа катионов. Третья группа катионов
Стр 1 из 4Следующая ⇒
Реагент
Первая группа катионов
NH4+
(K/Na)OH
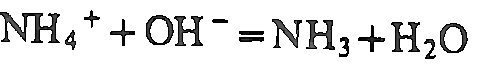
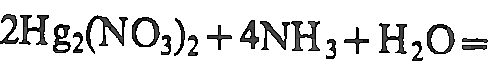
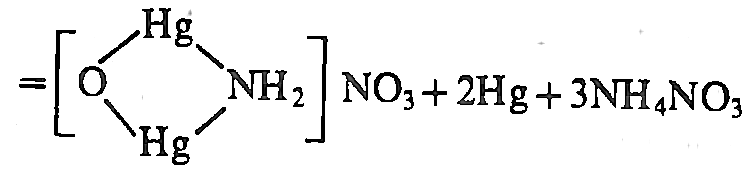
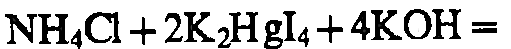
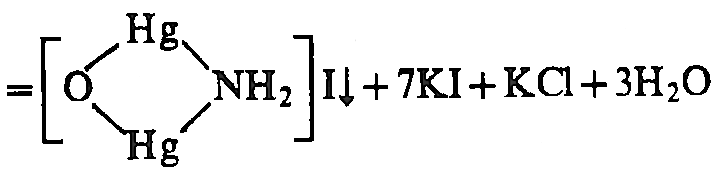
Na+
M(UO2)3(CH3COO)8
M=Zn/Ni
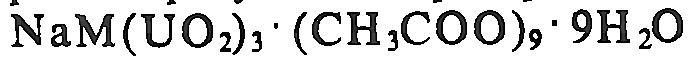
M=Zn ↑(тоже)
K+
NaHC4H4O6
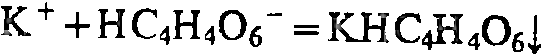
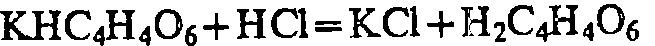
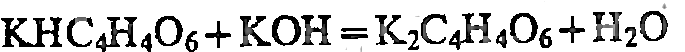
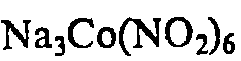
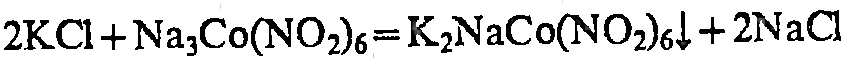

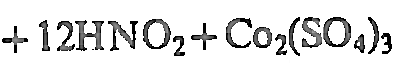
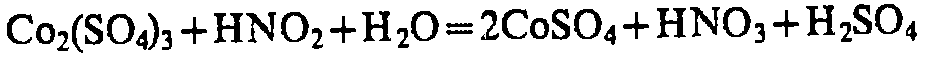
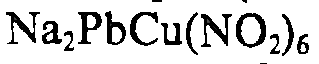
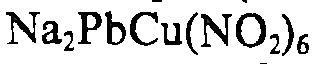 + 2К+=
+ 2К+= 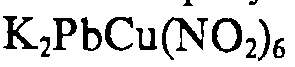
окрашивание пламени
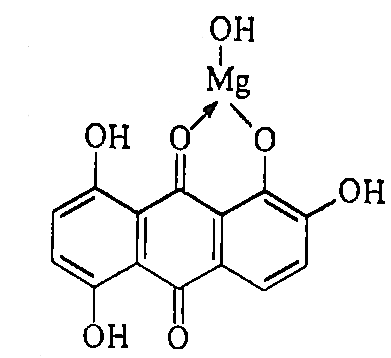
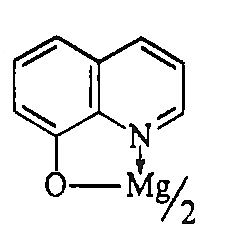
Mg2+
Na2HPO4
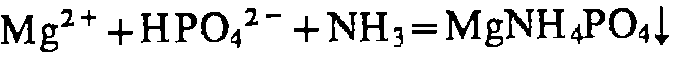
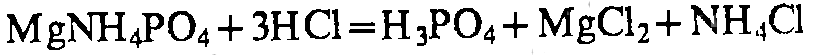
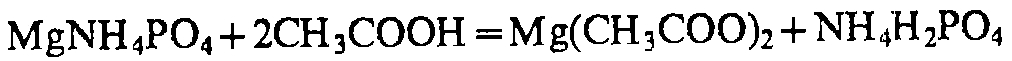
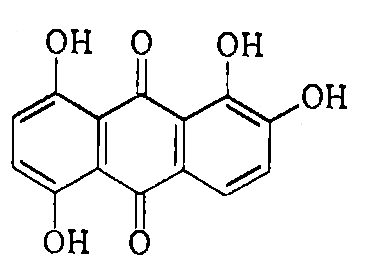
хинализарин
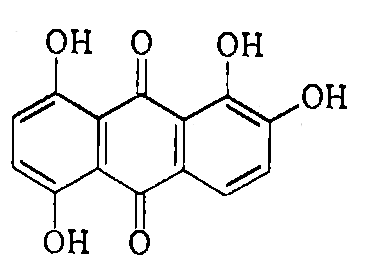 =
= 
8-оксихинолин
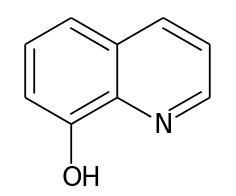
 =
= 
Вторая группа катионов
Сa2+
(NH4)2C2O4
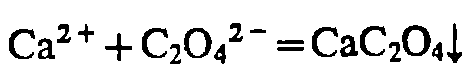
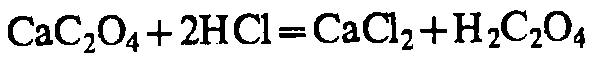
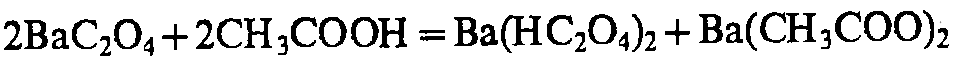
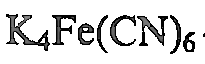
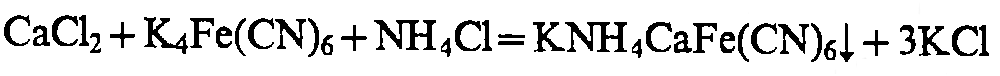
H2SO4
окрашивание пламени
Sr2+
гипсовая вода
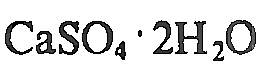
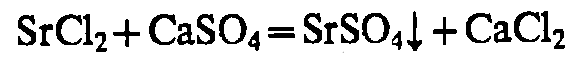
окрашивание пламени
Ba2+
K2Cr2O7
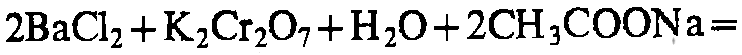
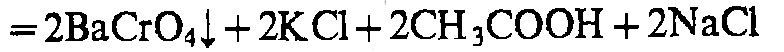
H2SO4 и SO42-
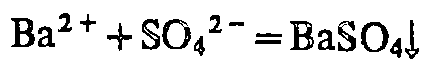
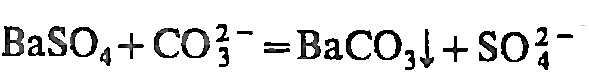
окрашивание пламени
Третья группа катионов
Ag+
H2S, (NH4)2S
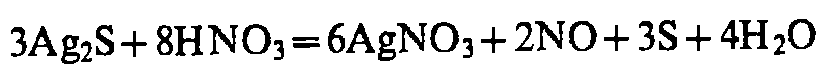
Hal-
=Cl-,Br-,I-
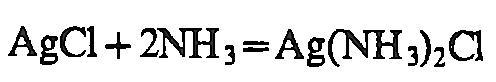
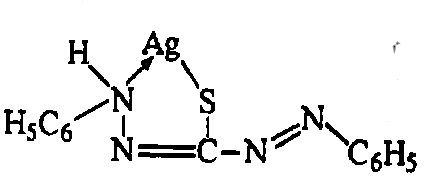
дитизон
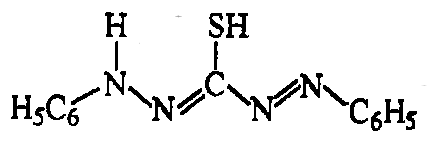
 =
=
=
= 
Hg22+
H2S, (NH4)2S
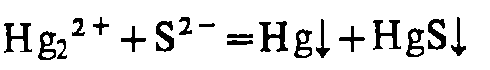
NH3
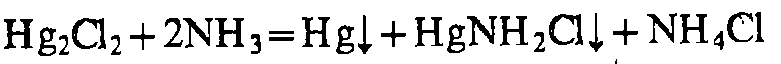
соляная кислота
HCl(H2O)
Pb2+
K2Cr2O7 / K2CrO4
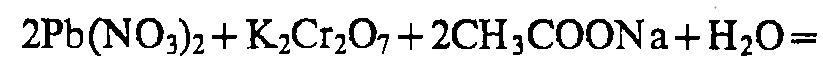
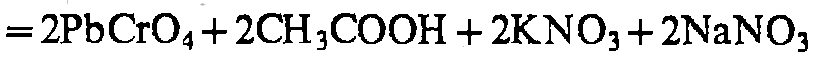
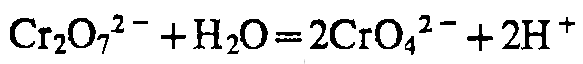
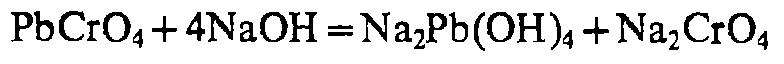
KI
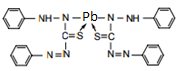
дитизон

 + Pb2+ =
=
+ Pb2+ =
= 
соляная кислота
HCl(H2O)
W6+
HCl,HNO3,H2SO4
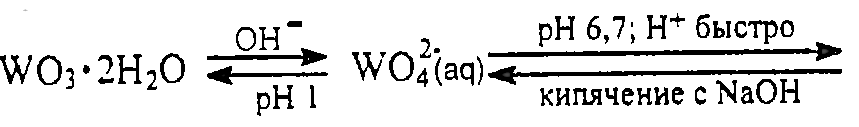 WO3*2H2O→WO3*H2O+H2O
WO3*2H2O→WO3*H2O+H2O
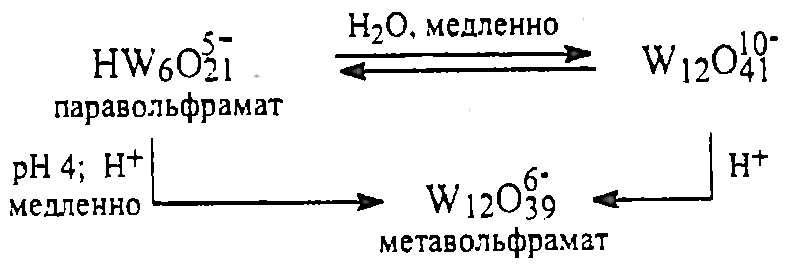
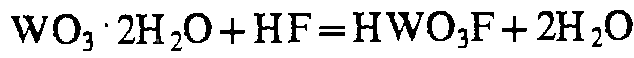
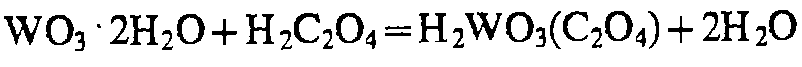
H2S, (NH4)2S
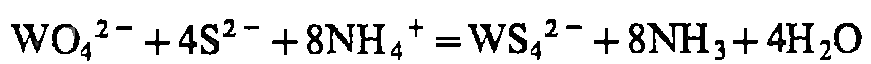
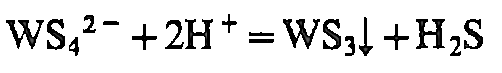
Zn, Al, SnCl2
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|