
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
ПАЦИЕНТ С ЗАТЯЖНЫМ КАШЛЕМ В УСЛОВИЯХ ПАНДЕМИИ COVID-19
ПАЦИЕНТ С ЗАТЯЖНЫМ КАШЛЕМ В УСЛОВИЯХ ПАНДЕМИИ COVID-19
Ж.В. Антонович
Белорусский государственный медицинский университет, Минск
Представлен современный алгоритм ведения пациентов с кашлем, рассмотрены механизмы, участвующие в затяжном кашле при респираторных вирусных инфекциях иCOVID-19, показана роль антилейкотриеновых препаратов при затяжном кашле, рассмотрены противовоспалительный и противовирусный эффекты монтелукаста, освещены новые потенциальные возможности использования монтелукаста в лечении инфекции COVID-19.
Ключевые слова: затяжной кашель, острые респираторные вирусные инфекции, COVID-19, антагонисты лейкотриеновых рецепторов, монтелукаст.
Кашель является одним из наиболее распространенных симптомов, по поводу которых пациенты обращаются за медицинской помощью к врачам первичного звена и пульмонологам [1-4].
Будучи очень распространенным симптомом, наблюдаемым при многих заболеваниях, кашель представляет собой важный защитный рефлекс, усиливая клиренс секрета и частиц из дыхательных путей (ДП) и защищая нижние ДП от аспирации чужеродных материалов [1, 2].
Механизмы защиты нижних отделов ДП включают механические факторы, к которым относится кашель, и механизмы неспецифического и специфического иммунитета [5]. Помимо кашля, механическими факторами защиты ДП являются аэродинамическая фильтрация, разветвление бронхов, надгортанник, чихание, колебательные движения ресничек мерцательного эпителия ДП [5].
Кашлем сопровождаются многие заболевания, помимо тех, которые поражают дыхательную систему. Распознать причину кашля не всегда легко.
По возможности, врач должен избегать лечения, основанного только на симптомах, цель которого успокоить пациента или его родителей (в случае педиатрического пациента). С другой стороны, стоит отметить, что врачи часто сталкиваются с просьбами пациентов с кашлем о помощи. В этой ситуации лечение симптомов само по себе представляется оправданным в качестве терапевтического подхода. Преимуществом раннего лечения кашля как симптома также является профилактика порочного круга кашля [1].
Тем не менее, следует подчеркнуть, необходимость высокого уровня настороженности, особенно при кашле, который сохраняется, становится затяжным. В таких случаях требуется тщательное обследование пациента с целью выявления возможных причин кашля [1, 2, 6].
Оценка продолжительности кашля на современном этапе рассматривается как первый шаг для сужения списка возможных причин кашля и потенциальных диагнозов.
В настоящее время выделяют [1, 2, 6]:
1) острый кашель (длится <3 недель);
2) подострый кашель (длится 3-8 недель);
3) хронический кашель (длится >8 недель).
На основании оценки продолжительности кашля разработаны диагностические подходы и алгоритмы ведения пациентов с острым, подострым и хроническим кашлем (рисунки 1, 2, 3) [1, 6].
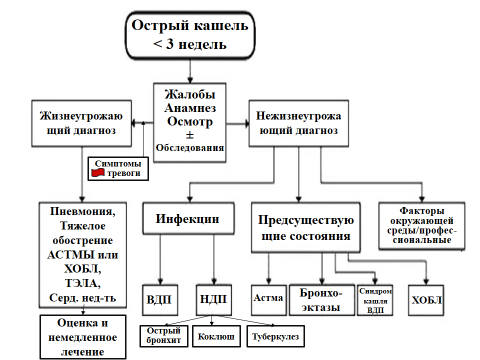
Рисунок 1. Алгоритм ведения пациентов в возрасте ≥ 15 лет с острым кашлем (продолжительностью <3 недель)
ХОБЛ – хроническая обструктивная болезнь легких; ТЭЛА – тромбоэмболия легочной артерии; ВДП – верхние дыхательные пути; НДП – нижние дыхательные пути.
Адаптировано из Irwin R.S., French C.L., Chang A.B. et al. Classification of Cough as a Symptom in Adults and Management Algorithms. CHEST Guideline and Expert Panel Report. Chest, 2018, vol.153, pp.196-209 [6].
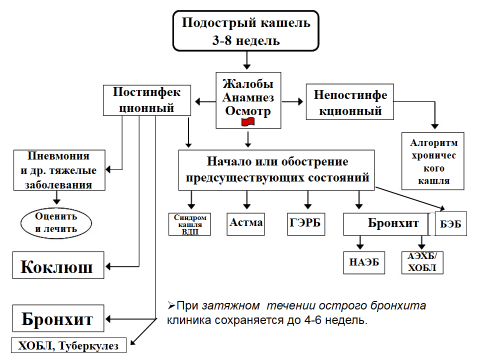
Рисунок 2. Алгоритм ведения пациентов в возрасте ≥ 15 лет с подострым кашлем (продолжительностью от 3 до 8 недель)
ХОБЛ – хроническая обструктивная болезнь легких; ВДП – верхние дыхательные пути; ГЭРБ – гастроэзофагеальная рефлюксная болезнь; НАЭБ – неастматический эозинофильный бронхит; АЭХБ – астматический эозинофильный хронический бронхит; БЭБ – бронхоэктатическая болезнь.
Адаптировано из Irwin R.S., French C.L., Chang A.B. et al. Classification of Cough as a Symptom in Adults and Management Algorithms. CHEST Guideline and Expert Panel Report. Chest, 2018, vol.153, pp.196-209 [6].
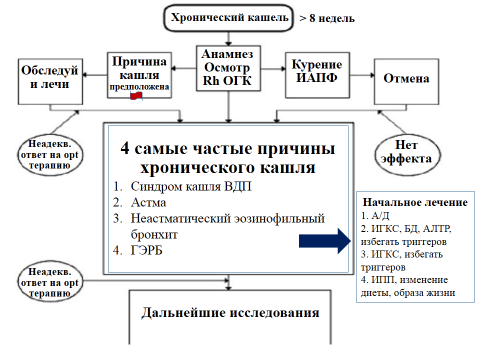
Рисунок 3. Алгоритм ведения пациентов в возрасте ≥ 15 лет с хроническим кашлем (продолжительностью более 8 недель)
Rh ОГК – рентгенограмма органов грудной клетки; ИАПФ – ингибиторы ангиотензин-превращающего фермента; ВДП – верхние дыхательные пути; ГЭРБ – гастроэзофагеальная рефлюксная болезнь; А/Д – антигистаминные/деконгестанты; ИГКС – ингаляционные глюкокортикостероиды; БД – бронходилататоры; АЛТР – антагонисты лейкотриеновых рецепторов; ИПП – ингибиторы протонной помпы.
Адаптировано из Irwin R.S., French C.L., Chang A.B. et al. Classification of Cough as a Symptom in Adults and Management Algorithms. CHEST Guideline and Expert Panel Report. Chest, 2018, vol.153, pp.196-209 [6].
Как видно из представленных алгоритмов, первым шагом при работе с пациентом, предъявляющим жалобы на кашель, является первичная клиническая оценка, включающая:
1) проверку на наличие симптомов тревоги,
2) оценку влияния экологических и профессиональных факторов, включая курение (как
активное, так и пассивное),
3) уточнение факта приема лекарств, вызывающих кашель, в первую очередь ингибиторов АПФ [6].
Особую настороженность следует проявлять у пациентов с симптомами тревоги. При наличии симптомов тревоги необходимо проведение немедленного обследования и лечения установленной причины кашля [6].
Симптомы тревоги [6]
1. Кровохарканье.
2. Курящие лица в возрасте старше 45 лет с новым кашлем, изменением кашля или голоса.
3. Курящие лица в возрасте 55-80 лет с индексом курящего человека (ИКЧ) 30 пачка/лет или бросившие курить в течение последних 15 лет.
4. Выраженная одышка, особенно в покое и ночью.
5. Охриплость.
6. Системные симптомы (повышение температуры тела, потеря массы тела, отеки или увеличение веса).
7. Проблемы с глотанием.
8. Рвота.
9. Рецидивирующая пневмония.
10. Изменения при обследовании и выполнении рентгенограммы органов грудной клетки, совпадающие с длительностью кашля.
В случае затяжного, хронического кашля и отсутствия симптомов тревоги наиболее частыми причинами являются [2, 4, 6]:
1) синдром кашля верхних ДП, вторичный к риносинуситу (ранее, синдром постназального затекания);
2) бронхиальная астма (БА) и ее кашлевой вариант;
3) неастматический эозинофильный бронхит (НАЭБ);
4) гастроэзофагеальная рефлюксная болезнь (ГЭРБ).
Второй шаг при ведении пациента с хроническим кашлем включает оценку и лечение наиболее частых причин [2, 4, 6].
Так, при синдроме кашля верхних ДП показаны визуализация придаточных пазух носа, назофарингоскопия, аллергообследование и эмпирическое лечение (например, назначение антигистаминных/деконгестантов) [2, 4, 6].
При подозрении на БА выполняются спирометрия, бронходилатационный / бронхопровокационный тесты, аллергообследование [2, 4, 6]. Назначается эмпирическая терапия, включающая ингаляционные глюкокортикостероиды (ИГКС), бронходилататоры (БД), антагонисты лейкотриеновых рецепторов (АЛТР) [2, 4, 6]. Рекомендуется избегать триггеров, контакта с причинно-значимыми аллергенами [2, 4, 6].
При НАЭБ исследуются эозинофилия мокроты, оксид азота в выдыхаемом воздухе, проводится аллергообследование и эмпирическое лечение (ИГКС, избегать триггеров) [2, 4, 6].
Начальное лечение при ГЭРБ – это больше чем снижение кислотопродукции! Эмпирическая терапия в этом случае включает изменение диеты, модификацию образа жизни, назначение ингибиторов протонной помпы [2, 4, 6].
Неадекватный ответ на оптимальную терапию через 4-6 недель указывает на необходимость перейти на третий шаг и рассмотреть другие причины хронического кашля, например, неастматические заболевания легких (ХОБЛ, бронхиолит, интерстициальные болезни легких, рак легкого, бронхоэктазы, микобактериальная инфекция), синдром обструктивного апноэ сна, сердечные аритмии, синдром соматического кашля (ранее психогенный кашель) [6, 7]. В этом случае требуется проведение дальнейших исследований [6, 7].
Дальнейшие исследования в случае неадекватного ответа на оптимальную терапию наиболее вероятной причины хронического кашля через 4-6 недель лечения[6]
1. 24-часовая рН/импеданс метрия
2. Эзофагогастродуоденоскопия и/или видеофлуороскопическая оценка глотания
3. Рентгеноскопия желудка с барием
4. Визуализация придаточных пазух носа
5. Компьютерная томограмма органов грудной клетки высокого разрешения
6. Бронхоскопия
7. Электрокардиограмма (ЭКГ), холтер-ЭКГ, ЭХО-кардиограмма
8. Оценка факторов окружающей среды и профессиональных факторов
9. Рассмотреть необычные/редкие причины хронического кашля
Четвертый шаг алгоритма ведения пациента с хроническим кашлем предлагает рассмотреть рефрактерный хронический кашель [6].
Пошаговое ведение пациентов с хроническим кашлем представлено в таблице 1 [7].
Таблица 1.
Пошаговое ведение пациентов с хроническим кашлем [7]
| Шаг | Алгоритм действий |
| Первичная клиническая оценка - Проверка на наличие симптомов тревоги - Оценка влияния экологических и профессиональных факторов - Прием лекарств (ингибиторы АПФ) | |
| Оценка и лечение наиболее частых причин - Синдром кашля верхних дыхательных путей - Астма и кашлевой вариант астмы - Неастматический эозинофильный бронхит - Гастроэзофагеальная рефлюксная болезнь | |
| Рассмотреть другие причины кашля в случае неадекватного ответа на лечение | |
| Рассмотреть рефрактерный хронический кашель |
Новая коронавирусная инфекция, вызванная SARS-CoV-2 (COVID-19), характеризуется клиническими симптомами острой респираторной вирусной инфекции (ОРВИ), среди которых кашель (сухой или с небольшим количеством мокроты) отмечается у 80% пациентов, уступая по частоте встречаемости лишь повышению температуры тела (у 90% пациентов). Также пациентов беспокоит одышка (30% случаев), утомляемость (40%), ощущение заложенности в грудной клетке (>20%). Могут отмечаться боль в горле, насморк, снижение обоняния и вкуса, признаки конъюнктивита. Среди первых симптомов заболевания могут быть миалгия (11%), спутанность сознания (9%), головные боли (8%), кровохарканье (2-3%), диарея (3%), тошнота, рвота, сердцебиение [8].
В проведенных исследованиях были продемонстрированы различные механизмы, участвующие в возникновении и сохранении кашля при ОРВИ [9-11]. Однако, точные механизмы, участвующие в затяжном, хроническом кашле при ОРВИ, выяснены не полностью [9, 10].
Было показано, что вирусные инфекции ДП приводят к стимуляции афферентных нервов медиаторами воспаления и продуктами окислительного стресса в ДП, а также к увеличению их возбудимости [9].
Вирусная инфекция также вызывает экспрессию рецепторов кашля [10].
Поствирусный кашель может быть связан с изменением центральных нейронных сетей и снижением порога кашлевого рефлекса [9, 10].
ОРВИ могут приводить к гиперреактивности ДП, то есть, возникновению бронхоспазма в ответ на различные стимулы: раздражители, смех, нагрузку. Гиперреактивность ДП может сохраняться долго и вести к развитию БА [11].
Так, в одном из исследований показано, что у 100% детей с первым эпизодом удушья выявлены респираторные вирусы и их коинфекции: риновирус (76%), респираторно-синцитиальный вирус (РСВ) (29%), бокавирус (18%), коронавирус (4,5%) и др. Доминировал риновирус и был ассоциирован с атопией, которая имела место у 56% детей, длительным кашлем и курением родителей [12].
В недавнем исследовании продемонстрировано, что наиболее частыми вирусами при обострении астмы являются вирусы семейства пикорнавирусов (риновирус, энтеровирус), и выявлены их прямые корреляции с уровнями эозинофилов и общего иммуноглобулина Е (IgE) крови, то есть с уровнем аллергического воспаления при БА [13].
Установлено, что тучные клетки, расположенные в подслизистой оболочке ДП, активируются вирусом SARS-CoV-2. После активации тучных клеток происходит дегрануляция с высвобождением гистамина и протеаз (рисунок 4) [14]. Поздняя активация тучных клеток приводит к высвобождению провоспалительных цитокинов, таких как интерлейкин (IL)-1, IL-6 и TNF-α (рисунок 4) [14]. Указанные механизмы могут лежать в основе воспаления ДП и бронхоконстрикции при SARS-CoV-2.
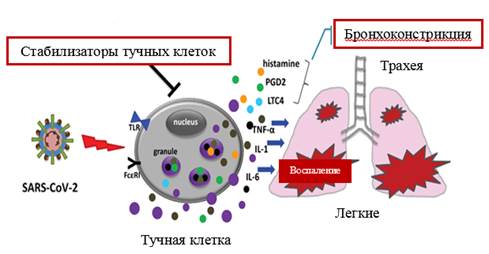
Рисунок 4. Активация тучных клеток вирусом SARS-CoV-2 [14]
Также показано, что ОРВИ активируют 5-липоксигеназу в слизистой оболочке бронхов, обеспечивая таким образом повышенный синтез цистеиниловых лейкотриенов в нижних ДП [11].
Повышенные концентрации цистеиниловых лейкотриенов обнаружены в назальном секрете взрослых, инфицированных РСВ, риновирусом и вирусом гриппа А [15], а также наблюдались у детей с бронхиолитом, вызванным РСВ [16], и у детей с вирус-индуцированным удушьем [17]. Кроме повышения концентрации, респираторные вирусы могут также повышать чувствительность ДП к лейкотриенам, увеличивая продукцию интерферона-γ [17], тем самым увеличивая экспрессию рецептора цистеиниловых лейкотриенов 1-го типа [18].
Выделяемые преимущественно тучными клетками и эозинофилами цистеиниловые лейкотриены являются мощными бронхоконстрикторами и медиаторами воспаления [19].
В литературе описаны многочисленные провоспалительные эффекты лейкотриенов в ДП [19, 20]. Известно, что лейкотриены повышают проницаемость сосудистой стенки, увеличивают секрецию слизи и замедляют ее движение, стимулируют миграцию клеток в очаг воспаления и вызывают сокращение гладких мышц бронхов [20].Это вид медиаторов, ингибирование которого приводит к улучшению функции легких и уменьшению выраженности симптомов БА [19].
Антилейкотриеновые препараты включают антагонисты рецепторов цистеиниловых лейкотриенов 1-го субтипа (монтелукаст, пранлукаст и зафирлукаст), а также ингибитор 5-липоксигеназы (зилейтон).
Данные клинических исследований показали, что АЛТР предотвращают бронхоспазм, обладают некоторым бронхорасширяющим эффектом, уменьшают выраженность симптомов БА, включая кашель [21], улучшают функцию легких, уменьшают гиперреактивность ДП и
активность воспаления в ДП, а также снижают частоту обострений астмы [22-24].
Наиболее изученным АЛТР является Монтелукаст, представленный в нашей стране под названием Синглон (Гедеон Рихтер).
Исследования показывают эффективность монтелукаста в лечении хронического кашля. Так, после 3-х недель терапии монтелукастом кашель полностью прекратился у 68% детей с хроническим кашлем. Лучший ответ на терапию наблюдался у пациентов, имеющих исходно высокий уровень эозинофилов и IgE в крови [25].
Систематический обзор 14 рандомизированных контролируемых исследований (1372 пациента) продемонстрировал значимый эффект монтелукаста в уменьшении частоты, тяжести и длительности постинфекционного кашля, улучшении качества жизни пациентов. Не было зафиксировано ни одного серьезного побочного эффекта [26].
Согласно рекомендациям Европейского респираторного общества 2020 года при хроническом кашле у взрослых краткосрочное назначение (2-4 недели) АЛТР имеет одинаковый уровень доказательности по сравнению с краткосрочным назначением ИГКС (2–4 недели), особенно у пациентов с астматическим кашлем [2].
В настоящее время наука и здравоохранение всего мира ищет эффективные способы лечения и профилактики COVID-19.
Американские, китайские и итальянские ученые независимо друг от друга выявили, что монтелукаст является одним из перспективных препаратов для дальнейшего изучения в этом направлении [27].
В мае 2020 г. была опубликована гипотеза, согласно которой монтелукаст представляет собой привлекательный потенциальный препарат для лечения COVID-19, благодаря своему механизму действия [28].
Известно, что монтелукаст оказывает противовоспалительное действиене только путем прямой блокады лейкотриеновых рецепторов, но также путем ингибирования экспрессии цитокинов и хемокинов в активированных макрофагах (М2 фенотипа) [29]. Данный эффект может лежать в основе снижения вероятности возникновения либо выраженности цитокинового шторма при инфекции COVID-19 [29].
Было установлено, что монтелукаст, благодаря своей молекулярной структуре, может встраиваться в участок фермента 3CL pro, необходимый для репликации коронавируса, и тем самым оказывать противовирусное действие (рисунок 5) [30].
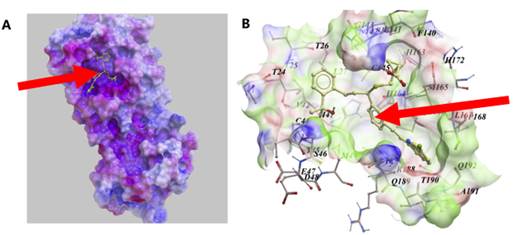
Рисунок 5. (A) Монтелукаст отлично «вписывается» в активный участок коронавирусного фермента 3CLpro (молекулярный докинг, или «ключ-замок»).
(B) Более детальный вид монтелукаста, связанного с активным участком 3CLpro[30]
3CL pro, 3-химотрипсин-подобная цистеинпротеаза, представляет собой ключевой фермент в жизненном цикле SARS-CoV-2, так как активирует белки, принимающие участие в репликации вирусного генома [31, 32]. Препарат, который разрушает эту протеазу, может повлиять на способность вируса к размножению [30, 31].
Активность монтелукаста в ингибировании фермента 3CLpro, играющего ключевую роль в репликации коронавируса, оказалась выше, чем у многих других противовирусных препаратов (таблица 2) [32].
Таблица 2.
Активность монтелукаста в ингибировании фермента 3CLpro, играющего ключевую роль в репликации вируса SARS-CoV-2 [32].
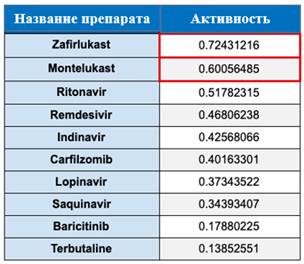
Представленные результаты являются предварительными и требуют тщательного изучения, прежде чем будут сделаны какие-либо выводы.
На сегодняшний день Синглон как АЛТРне только рекомендован к использованию в качестве базисной терапии БА [33] и лечения хронического кашля [2, 6], ноиявляется препаратом выбора в следующих клинических ситуациях:
1) БА у пациента сочетается с аллергическим ринитом и/или атопическим дерматитом;
2) пациент не способен использовать ИГКС (например, возникновение затруднений при использовании ингалятора у маленьких детей);
3) пациент не желает использовать ИГКС (например, ГКС-фобия);
4) ИГКС вызывают у пациента труднопереносимые побочные эффекты (например, постоянную охриплость голоса, дисфонию).
Эффективно использование Синглона для профилактики бронхоспазма перед физической нагрузкой, а также в лечении ночной и аспириновой БА [34].
Волнующими выглядят новые данные о потенциальной возможности применения монтелукаста в лечении инфекции COVID-19.
С одной стороны, монтелукаст обладает противовоспалительными свойствами и снижает вероятность возникновения либо выраженность цитокинового шторма, ингибируя экспрессию цитокинов и хемокинов в активированных макрофагах [29].
С другой стороны, монтелукаст, благодаря своей молекулярной структуре, может встраиваться в участок фермента, необходимый для репликации коронавируса SARS-CoV-2 и тем самым оказывать противовирусное действие [30].
Заключение
Современный пошаговый алгоритм ведения пациентов с кашлем, основанный на его продолжительности, позволяет сузить список возможных причин кашля и определить диагностическую и лечебную тактику.
Понимание причин и механизмов, участвующих в затяжном и хроническом кашле, помогает определить наиболее вероятную причину кашля и назначить оптимальную терапию.
Монтелукаст, широко используемый в качестве базисной терапии БА, в настоящее время также рекомендован к назначению при хроническом кашле у взрослых, и, обладая противовоспалительным и противовирусным эффектами, рассматривается как потенциально перспективный препарат для лечения инфекции COVID-19.
ЛИТЕРАТУРА
1. De Blasio F., Virchow J.C., Polverino M. et al. Cough management: a practical approach // Cough. 2011; 7: 7 http://www.coughjournal.com/content/7/1/7
2. Morice A.H., Millqvist E., Bieksiene K. et al. ERS guidelines on the diagnosis and treatment of chronic cough in adults and children // Eur. Respir. J. 2020; 55: 1901136 [https://doi.org/10.1183/ 13993003.01136-2019].
3. Song W.J. Chang Y.S., Faruqi S. et al. The global epidemiology of chronic cough in adults: a systematic review and meta-analysis // Eur. Respir. J. 2015; 45(5): 1479-1481.
4. Kefang Lai, Huahao Shen, Xin Zhou et al. Clinical Practice Guidelines for Diagnosis and Management of Cough – Chinese Thoracic Society (CTS) Asthma Consortium // J. Thorac. Dis. 2018; 10(11): 6314-6351.
5. Внебольничная пневмония у взрослых: практические рекомендации по диагностике, лечению и профилактике: пособие для врачей / А.Г. Чучалин [и др.]. – М., 2010. – 106 с.
6. Irwin R.S., French C.L., Chang A.B. et al. Classification of Cough as a Symptom in Adults and Management Algorithms. CHEST Guideline and Expert Panel Report // Chest. 2018; 153: 196-209.
7. Perotin J., Launois C., Dewolf M. et al. Managing patients with chronic cough: challenges and solutions // Therapeutics and Clinical Risk Management. 2018; 14: 1041–1051.
8. Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19). Временные методические рекомендации МЗ РФ. Версия 7 (03.06.2020). – 166 с.
9. Undem B.J., Zaccone E., McGarvey L. et al. Neural dysfunction following respiratory viral infection as a cause of chronic cough hypersensitivity // Pulm. Pharmacol. Ther. 2015; 33: 52–56.
10. Abdullah H., Heaney L.G., Cosby S.L. et al. Rhinovirus upregulates transient receptor potential channels in a human neuronal cell line: implications for respiratory virus-induced cough reflex sensitivity // Thorax. 2014; 69(1): 46–54.
11. Seymour M.L., Gilby N., Bardin P.G. et al. Rhinovirus infection increases 5-lipoxygenase and cyclooxygenase-2 in bronchial biopsy specimens from nonatopic subjects // J. Infect. Dis. 2002; 185: 540–544.
12. Turunen R., Koistinen A., Vuorinen T. et al. The first wheezing episode: respiratory virus etiology, atopic characteristics, and illness severity // Pediatric Allergy and Immunology. 2015; 25: 796–803.
13. Aceves M.R., Balderas A.B., Ornelas M. Most commonly isolated viruses in asthma exacerbation and their correlation with eosinophil and total serum immunoglobulin E levels // Arch. Argent. Pediatr. 2018; 116(3): 192-197.
14. Arumugham V. Immunological mechanisms explaining the role of IgE, mast cells, histamine, elevating ferritin, IL-6, D-dimer, VEGF levels in COVID-19 and dengue, potential treatments such as mast cell stabilizers, antihistamines, Vitamin C, hydroxychloroquine, ivermectin and azithromycin. 2020. https://dx.doi.org/10.5281/zenodo.3748304
15. Gentile D.A., Fireman P., Skoner D.P. Elevations of local leukotriene C4 levels during viral upper respiratory tract infections // Ann. Allergy Asthma Immunol. 2003; 91: 270–274.
16. Kim C.K., Koh J.Y., Han T.H. et al. Increased levels of BAL cysteinyl leukotrienes in acute [corrected] RSV bronchiolitis // Acta Paediatr. 2006; 95: 479–485.
17. van Schaik S.M., Tristram D.A., Nagpal I.S. et al. Increased production of IFN-gamma and cysteinyl leukotrienes in virus-induced wheezing // J. Allergy Clin. Immunol. 1999; 103: 630–636.
18. Amrani Y., Moore P.E., Hoff man R. et al. Interferon-gamma modulates cysteinyl leukotriene receptor-1 expression and function in human airway myocytes // Respir. Crit. Care Med. 2001; 164: 2098–2101.
19. Leff A.R. Regulation of leukotrienes in the management of asthma: biology and clinical therapy // Annu. Rev. Med. 2001; 52: 1–14.
20. Hay D.W., Torphy T.J., Undem B.J. et al. Jeukotrienes in the pathogenesis of asthma // Chest. 1997; 111: 27S-35S.
21. Dicpinigaitis P.V., Dobkin J.B., Reichel J. Antitussive effect of the leukotriene-receptor antagonist afirlucast in subjects with cough-variant asthma // J. Asthma. 2002; 39 (4): 291-297.
22. Lipworth B.J. Leukotriene-receptor antagonists // Lancet. 1999; 353 (9146): 57-62.
23. Drazen J.M., Israel E., O,Byrne P.M. Treatment of asthma with drugs modifying the leukotriene pathway // N. Engl. J. Med. 1999; 340 (3): 197-206.
24. Barnes N.C., Miller C.G. Effect of leukotriene-receptor antagonists therapy on the risk of asthma exacerbations in patients with mild to moderate asthma: an integrated analysis of afirlucasts trials // Thorax. 2000; 55 (6): 478-483.
25. Kopriva F., Sobolova L, Szotkowska J. Treatment of chronic cough in children with montelukast, a leukotriene receptor antagonist // J. Asthma. 2004; 41 (7): 715-720.
26. Dong S., Zhong Y., Lu W. et al. Montelucast for postinfectious cough: a systematic review of randomized controlled trials // West Indian Med. J. 2016; 65(2): 350-357.
27. https://www.sciencedirect.com/science/article/pii/S2211383520302999?via%3Dihub
28. Fidan C., Aydoğdu A. As a potential treatment of COVID-19: Montelukast [published online ahead of print, 2020 May 11] // Med. Hypotheses. 2020; 142: 109828. doi:10.1016/j.mehy.2020.109828
29. Yi-Ching Lin, Ming-Yii Huang, Min-Sheng Lee et al. Effects of montelukast on M2-related cytokine and chemokine in M2 macrophages // J. Microb. Immun. and Inf. 2018; 51(1):18-26, ISSN 1684-1182,тhttps://doi.org/10.1016/j.jmii.2016.04.005.
30. Wu C., Liu Y., Zhang P. et al. Analysis of therapeutic targets for SARS-CoV-2 and discovery of potential drugs by computational methods // Acta Pharmaceutica Sinica B. 2020. https://doi.org/10.1016/j.apsb.2020.02.008
31. Qamar M.T., Alqahtani S.M., Alamri M.A. et al. Structural basis of SARS-CoV-2 3CLpro and anti-COVID-19 drug discovery from medicinal plants // Journal of Pharmaceutical Analysis. 2020 (March, 26) [in press], https://doi.org/10.1016/j.jpha.2020.03.009
32. https://www.hpcwire.com/2020/04/30/ml-and-good-luck-take-swipe-at-covid-19/
33. Global strategy for asthma management and prevention (Global initiative for asthma GINA) / Updated 2020. Mode of access: http://www.ginasthma.org. – 210 p.
34. Leff J.A., Busse W.W., Pearlman D. et al. Montelukast, leukotriene receptor antagonist, for the treatment of mild asthma and exercise-indused bronchoconstriction // N. Engl. J. Med. 1998; 339 (3): 147-152.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|