
- Р Р‡.МессенРТвЂВВВВВВВВжер
- ВКонтакте
- РћРТвЂВВВВВВВВнокласснРСвЂВВВВВВВВРєРСвЂВВВВВВВВ
- Telegram
- РњРѕР№ Р В Р’В Р РЋРЎв„ўР В Р’В Р РЋРІР‚ВВВВВВВВРЎР‚
- LiveJournal
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Классификация кислот.. Получение кислот.. Химические свойства.
КИСЛОТЫ. КЛАССИФИКАЦИЯ. ПОЛУЧЕНИЕ. СВОЙСТВА.
Кислоты - сложные вещества, состоящие из одного или нескольких атомов водорода, способных замещаться на атома металлов, и кислотных остатков.Число атомов водорода определяет основность кислот.
| Формула кислоты | Название |
| HCl | хлороводородная, или соляная кислота |
| HF | фтороводородная, или плавиковая кислота |
| HI | иодоводородная кислота |
| HBr | бромоводородная кислота |
| HNO2 | азотистая кислота |
| HNO3 | азотная кислота |
| H2S | сероводородная кислота |
| H2SO3 | сернистая кислота |
| H2SO4 | серная кислота |
| H2CO3 | угольная кислота |
| H2SiO3 | кремниевая кислота |
| H3PO4 | фосфорная кислота |
| CH3COOH | уксусная кислота |
HCN циановодородная кислота
Классификация кислот.

| HNO2, HNO3, H2SO3, H2SO4, H2CO3, H2SiO3, H3PO4 | HCl, HF, HI, H2S |
Сила кислот:
сильными считаются:1) из бескислородных кислот -HCl, HBr, HI;
2) из кислородсодержащих – если Δ(О-Н) =2 и больше
Получение кислот.
| Кислородсодержащие | 1.Кислотный оксид+вода | SO3+H2O=H2SO4 P2O5+3H2O=2H3PO4 |
| 2.Металл+сильный окислитель | P+5HNO3+2H2O=3H3PO4+5NO | |
| 3.Cоль+менее летучая кислота | NaNO3+H2SO4=HNO3 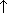 +NaHSO4 +NaHSO4
| |
| Бескислородные | 1.Водород+неметалл | H2+Cl2=2HCl |
| 2.Cоль+менее летучая кислота | NaCl+H2SO4=2HCl 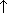 +NaHSO4 +NaHSO4
|
Химические свойства.
| Кислородсодержащие | Бескислородные |
| 1.Изменяют окраску индикаторов | |
| лакмус-красный, метилоранж-красный ( только для растворимых кислот) | |
| 2.Взаимодействие с металлами, стоящими до водорода | |
H2SO4+Ca=CaSO4+H2 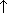
| 2HCl+Ca=CaCl2+H2 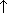
|
| 2.Взаимодействие с основными оксидами | |
| H2SO4+CaO=CaSO4+H2O | 2HCl+CaO=CaCl2+H2O |
| 3.Взаимодействие с основаниями | |
| H2SO4+Ca(OH)2=CaSO4+2H2O | 2HCl+Ca(OH)2=CaCl2+2H2O |
| 4.Взаимодействие с амфотерными оксидами | |
| H2SO4+ZnO=ZnSO4+H2O | 2HCl+ZnO=ZnCl2+H2O |
| 5.Взаимодействие с солями, если образуется малорастворимое, летучее или малодиссоциирующее вещество | |
| H2SO4+BaCl2=BaSO4+2HCl | 2HCl+Na2CO3=2NaCl+H2O+CO2 
|
| 6.При нагревании | |
| Слабые кислоты легко разлагаются H2SiO3=H2O+SiO2 | H2S=H2+S |
Номенклатура кислот:
| приставка | ди(би, дву…) | в названии кислот, полученных сложением кислоты и её же оксида , например: Н2CrO4 + CrO3 = H2Cr2O7 |
| корень | по русскому названию центрального атома | |
| суффикс | н (ев, ов) | в высшей кислоте, если ст. ок.(Э) =№ группы |
| (н) ист | в низшей кислоте, если ст. ок.(Э) =№ группы-2 | |
| (н) оват | в низшей кислоте, если ст. ок.(Э) =№ группы-4 | |
| новатист | в низшей кислоте, если ст. ок.(Э) =№ группы-6 | |
| окончание | ая | +слово «кислота» |
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|