
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
При химическом анализе в лаборатории был установлен количественный состав четырех веществ: А – H8N2O3C; Б – H2FeO2Cl; В – H2S2O6Ba; Г – S3Al2 O12.
Школьный этап Всероссийской олимпиады школьников по химии в Иловлинском муниципальном районе в 2016/2017 учебном году
8 класс
1. Названия веществ, простых или сложных часто употребляются в словосочетаниях. Определите эти вещества и допишите предложенные словосочетания:
_____________ дыра
Активированный _____________
________________ , _______________ , ______________ век
Дистиллированная ____________
_________________ клей
__________________ недостаточность
________________ лампа
________________ _________________ ложка
2. Определите, в каких фразах говорится о химическом элементе, а в каких – о простом веществе. Верному утверждению в таблице соответствует буква. Выберите эти буквы и составьте из них фамилию учёного – естествоиспытателя.
| Химический элемент | Простое вещество | |
| кальций необходим для роста клеток | Р | К |
| азот входит в состав воздуха | М | О |
| натрий входит в состав глауберовой соли | О | Е |
| натрий растворяется в ртути с образованием амальгамы | И | Д |
| кислород необходим для дыхания | Я | А |
| хлор получают электролизом расплава поваренной соли | Л | Г |
| капуста содержит около 0,08% серы | А | Б |
| фтор входит в состав зубной эмали | В | Н |
3. В состав человеческого организма входит в среднем по массе 65% кислорода, 18% углерода, 10% водорода, 0,15% натрия и 0,15% хлора. Расположите выше названные химические элементы в порядке уменьшения числа их атомов, содержащихся в организме человека.
4. В соединении титана с кислородом отношение масс элементов составляет 2 : 1. Установите формулу данного соединения. Определите валентность титана.
5. Ученик получил задание, в котором по названиям веществ необходимо было составить их химические формулы. Выполняя это задание, он не оставил пробелы между формулами веществ, в результате чего у него получилась запись:
H2OP2O5AlO2NaH2O3CO2Na3NCFeCl3N2К2SSiO2
1) Выделите из этой записи формулы индивидуальных веществ, подчеркните простые вещества;
2) Назовите вещества.
6. Лесные звери варили клюквенный компот. Клюквенный отвар получился очень кислым, пришлось добавлять сахар. В 4 кг отвара медведь высыпал пакет (1 кг) сахара, барсук - 1 стакан (200 г) сахара, заяц – 5 столовых ложек (15 г), белочка и ёжик – по 10 чайных ложек (5 г). Определите массовую долю сахара в полученном компоте.
7.Даны формулы оксидов азота: N2O - оксид азота (I); NO - оксид азота (II); N2O3 - оксид азота (III); NO2 - оксид азота (IV); N2O5 - оксид азота (V). Определите, в каком из этих соединений содержание азота наибольшее. Ответ округлите до десятых.
8.Юный любитель химии раздобыл порошок серебра, захотев с ним поэкспериментировать в домашних условиях. Но случайно просыпал его на пол. Мальчик расстроился, ведь он с таким трудом раздобыл этот порошок. И решил собрать его с пола. Пол, к сожалению, был «не очень чистым» и смесь, которую он подмел, содержала помимо порошка серебра всякие мелкие частицы: пух из подушки (скорее всего гусиный), древесные опилки, железные опилки, поваренную соль и сахар. Как мальчику избавиться от лишних примесей? Составьте подробный план действий, чтобы очистить серебряный порошок. Какие методы очистки и разделения вы бы предложили использовать и на каких физических явлениях они основаны?
Школьный этап Всероссийской олимпиады школьников по химии в Иловлинском муниципальном районе в 2016/2017 учебном году
9 класс
1. При химическом анализе в лаборатории был установлен количественный состав четырех веществ: А – H8N2O3C; Б – H2FeO2Cl; В – H2S2O6Ba; Г – S3Al2 O12.
К каким классам неорганических соединений относится каждое вещество? Назовите вещества А, Б, В, Г. Приведите по одному уравнению химической реакции, характерной для каждого вещества, и укажите условия их протекания.
2. Сульфид железа (II), полученный при сплавлении 4,8 г серы с порошком железа, обработали избытком раствора соляной кислоты. Выделившийся газ пропустили через раствор нитрата свинца (II). При этом выпал осадок массой 21,15 г. Напишите уравнения указанных реакций и определите выход получившегося осадка в процентах от теоретически возможного.
3. На схеме приведены превращения вещества Х
Х + О2 →
Х + Сl2 →
Х+ I2O5 →
C+ O2 → Х
Х+Ni →
Предложите Х и запишите уравнения соответствующих превращений.
4. В лаборатории приготовили водный раствор этилового спирта (С2Н5ОН) с массовой долей 10%. Плотность раствора спирта равна 0,98 г/мл. Рассчитайте число молекул спирта в 1 мл такого раствора.
5. Агроном заказал удобрения. Привезли 5 мешков, наполненных белыми гранулами, но без этикеток. В накладной были указаны следующие удобрения: натриевая селитра, аммиачная селитра, хлорид аммония, сульфат аммония, мочевина. Каким образом агроном может определить содержимое мешков, если в его распоряжении имеются вода и еще 3 необходимых реактива. Опишите его действия и приведите уравнения необходимых реакций.
Школьный этап Всероссийской олимпиады школьников по химии в Иловлинском муниципальном районе в 2016/2017 учебном году
10 класс
1. Рассчитайте массовую долю углерода в молекулах: а) этана; б) этилена; в) ацетилена. Каков характер пламени при горении этих веществ? Составьте уравнения реакций горения данных веществ.
2. Установите соответствие между названием алкана и его характеристикой
| Название алкана | Характеристика алкана |
| А) пропан | 1) имеет пять изомеров |
| Б) бутан | 2) имеет шесть изомеров |
| В) гексан | 3) имеет семь изомеров |
| Г) гептан | 4) имеет восемь изомеров |
| Д) диметилпропан | 5) имеет девять изомеров |
| Е) 2,3,4,5-тетраметилпропан | 6) не имеет изомеров |
| 7) является изомером метилпропана | |
| 8) является изомером 1,2-диметилгептана | |
| 9) не имеет в своем составе вторичных и третичных атомов углерода |
3.Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой
 HI + H2SO4 I2 + H2S + H2O
HI + H2SO4 I2 + H2S + H2O
Определите окислитель и восстановитель.
4.Учащимся для проведения опыта были выданы кристаллы соли белого цвета, которые при стоянии на воздухе изменяют окраску на голубую. Известно, что при разложении выданной соли образуется оксид металла чёрного цвета и ядовитый газ бурого цвета. Добавление к раствору выданной соли раствора гидроксида калия привело к образованию студенистого осадка голубого цвета.
Запишите химическую формулу и название выданной соли. Составьте два молекулярных уравнения реакций, соответствующих опытам, проведённым учащимися в процессе исследовании соли. Для второй реакции запишите полные и сокращённые ионные уравнения.
5.Продукты бромирования на свету 10,50 г циклогексана обработали избытком водно-спиртового раствора нитрата серебра. В результате выпало 35,10 г желтоватого, темнеющего на свету осадка. Определите состав продуктов бромирования, изобразите для них все возможные структурные и геометрические изомеры.
6.В лаборатории устанавливали состав газообразного органического соединения. Для анализа был взят образец объемом 448 мл (н.у.) и массой 1,16 г. Продукты сгорания этого образца полностью поглотились при последовательном пропускании их через трубку с оксидом фосфора(V) и концентрированным раствором гидроксида калия. Масса трубок увеличилась соответственно на 1,8 г и 3,52 г.
А.Какие выводы исследователи могут сделать на основании анализа результатов исследования?
Б.Какое соединение изучали в лаборатории? Выводы подтвердите соответствующими расчетами.
В.Напишите уравнения всех химических реакций, упомянутых в задаче.
Г.Имеет ли искомое соединение изомеры? Если имеет, то напишите их структурные формулы и назовите по систематической номенклатуре.
Школьный этап Всероссийской олимпиады школьников по химии в Иловлинском муниципальном районе в 2016/2017 учебном году
11 класс
Задача 1. Для ухода за кожей рук рекомендуют использовать эмульсионные кремы на основе вазелинового масла, в которых содержится до 14% пчелиного воска, около 35% воды, 1% тетрабората натрия Nа2B4O7 и другие вещества. Для приготовления такого крема используют кристаллогидрат тетрабората натрия. Рассчитайте массу декагидрата тетрабората натрия, который требуется для приготовления 60 г такого крема.
Задача 2.Восстановите левую или правую часть уравнений следующих химических реакций
1) … → MnBr2 + Br2 + 2H2O
2) … → 2CaCO3↓ + 2H2O
3) … → 4Fe(OH)3↓ + 4Na2SO4
4) CuS + 4H2O2 → …
5) 6HNO3 + P2O5 → …
Задача 3. В лаборатории устанавливали состав газообразного органического соединения. Для анализа был взят образец объемом 448 мл (н.у.) и массой 1,16 г. Продукты сгорания этого образца полностью поглотились при последовательном пропускании их через трубку с оксидом фосфора(V) и концентрированным раствором гидроксида калия. Масса трубок увеличилась соответственно на 1,8 г и 3,52 г.
А.Какие выводы исследователи могут сделать на основании анализа результатов исследования?
Б.Какое соединение изучали в лаборатории? Выводы подтвердите соответствующими расчетами.
В.Напишите уравнения всех химических реакций, упомянутых в задаче.
Г.Имеет ли искомое соединение изомеры? Если имеет, то напишите их структурные формулы и назовите по систематической номенклатуре.
Задача 4.Избыток сернистого ангидрида пропустили через раствор перманганата калия. Образовался раствор серной кислоты с концентрацией 4,9 %. Определите концентрацию исходного раствора перманганата.
Задача 5.В представленной схеме превращений вещество А относится к гомологическому ряду бензола и является монозамещенным производным. Массовая доля углерода в этом углеводороде равна 90,57 %, а его молярная масса не превышает 110 г/моль.
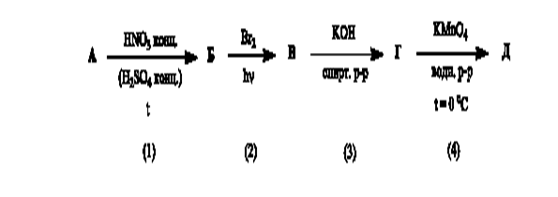
А.Установите структурную формулу вещества А.
Б.Напишите уравнения химических реакций в соответствии со схемой.
В.Назовите вещества А-Е.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|