
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Задания школьного этапа. всероссийской олимпиады школьников. по химии 2020-2021 учебного года. Республика Башкортостан
Задания школьного этапа
всероссийской олимпиады школьников
по химии 2020-2021 учебного года
Республика Башкортостан
9 класс
Задача 9-1. При нагревании бертолетовой соли часть ее разлагается с
выделением кислорода, а некоторая часть разлагается без выделения кислорода. В условиях опыта при полном разложении 44,1г бертолетовой соли выделилось 6,72л (н.у.) кислорода. Назовите условия протекания обеих реакций. Напишите уравнения реакций. Вычислить массу и состав твердого остатка при полном разложении данной массы бертолетовой соли.
Задача 9-2. Рассчитайте энтальпию образования жидкого сероуглерода по следующим данным:
1) S(ромб) + O2(г) → SO2(г) 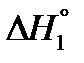 = –296,9 кДж.
= –296,9 кДж.
2) CS2(жд) + 3O2(г) → CO2(г) + 2SO2(г) 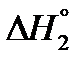 = –1109 кДж.
= –1109 кДж.
3) C(графт) + O2(г) → CO2(г) 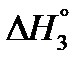 = –393,5 кДж.
= –393,5 кДж.
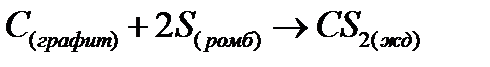
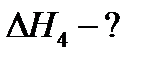
Задача 9-3.Смесь карбоната кальция, сульфида цинка и хлорида натрия общей массой 40 г обработали избытком соляной кислоты. При этом выделилось 6,72 л (н.у.) газов, при взаимодействии которых с избытком сернистого газа образовалось 9,6 г твердого продукта. Напишите уравнения реакций и массовые доли компонентов в исходной смеси.
Задача 9-4. Раствор, содержащий 34 г нитрата серебра смешивают с раствором, содержащим такое же количество хлорида натрия. Все ли количество нитрата серебра вступит в реакцию? Сколько грамм хлорида серебра образуется в результате реакции?
10 класс
Задача 10-1.Неизвестную массу карбоната кальция внесли в раствор соляной кислоты, при этом соль полностью растворилась. После полного растворения соли масса образовавшегося раствора увеличилась по сравнению с массой исходного раствора соляной кислоты на 5.6г. Напишите уравнение реакции. Назовите причину увеличения массы раствора после реакции. Какова масса исходного карбоната кальция, растворенная в соляной кислоте?
Задача 10-2.. Определите теплоту образования метилового спирта исходя из данных для реакции
2CH3OH + 3O2 → 2CO2 + 4H2O + 1475,16кДж
| 2CH3OH + 3O2 → 2CO2 + 4H2O | ||||
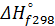 ,кДж/моль ,кДж/моль
| ? | -393,5 | -285,84 | |
Задача 10-3.При внутримолекулярной дегидратации предельного одноатомного спирта образуется газообразный углеводород. Некоторое количество этого углеводорода способно прореагировать с 60 г 5%-ного раствора брома в гексане. При сжигании такого же количества вещества выделяется 1,26 л углекислого газа. Какой спирт и в каком количестве был взят для дегидратации ?
Задача 10-4. Определить процентное содержание доломита в руде, если при разложении 40 г ее выделяется 8,96 л СО2 (н.у.).
11 класс
Задача 11-1.К 400г 11.1%-ного раствора хлорида кальция добавили 57.2г десятиводного карбоната натрия. Через полученный раствор пропустили 3.36л углекислого газа. Напишите уравнения протекающих реакций в данной системе. Какие соли присутствуют в полученном растворе? Вычислите массовые доли солей в образовавшемся растворе.
Задача 11-2.Образец смеси метилацетата и метилформиата массой 15,52 г обработали при нагревании 68 мл раствора гидроксида бария с концентрацией 2,5 моль/л. Избыток основания может реагировать с 45,4 мл раствора 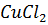 (массовая доля 0,135, плотность 1,1 г/мл) с образованием осадка. Рассчитайте массовые доли сложных эфиров в смеси.
(массовая доля 0,135, плотность 1,1 г/мл) с образованием осадка. Рассчитайте массовые доли сложных эфиров в смеси.
Задача 11-3. Пропуская воздух через электрическую дугу, получают окись азота. Определите константу равновесия, если равновесный выход окиси азота при 1500 ºС составляет 0,325%, а при 2400ºС – 2,24%.
N2 + O2 = 2NO
Задача 11-4. Вывести формулу кристаллогидрата соды, зная, что при прокаливании 14,3 г кристаллогидрата получается 5,3 г безводной соли.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|