
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Закон Авогадро и следствия из него
3. Закон Авогадро и следствия из него
В равных объемах газов (V) при одинаковых условиях (температуре Т и давлении Р) содержится одинаковое число молекул.
Следствие из закона Авогадро: один моль любого газа при одинаковых условиях занимает одинаковый объем.
В частности, при нормальных условиях, т.е. при 0° С (273 К) и 101,3 кПа, объем 1 моля газа, равен 22,4 л.
Нахождение относительной молекулярной массы
Задание: Вычислить относительную молекулярную массу молекулы серной кислоты (H2SO4) и её массу в г.
| № п/п | Последовательность действий | Выполнение действий |
| 1. | Записать молекулярную формулу серной кислоты. | H2SO4 |
| 2. | Подсчитать по формуле относительную молекулярную массу. | M(r) = 2*1 + 32 + 4*16=98 а.е.м. |
| 3. | Перейти к молярной массе. | M=98 г/моль |
| 4. | Найти массу молекулы в г, поделив массу 1 моль на число молекул в моле ( NA = 6,02*1023) | m(H2SO4 в г) = 98 г/6,02*1023 = 16,3*10-23 г |
| 5. | Записать ответ. | Ответ: относительная молекулярная масса молекулы серной кислоты равна 98 а.е.м. Масса молекулы в г 16,3*10-23 |
ПРАКТИЧЕСКОЕ ЗАДАНИЕ
Задача 1. Пользуясь периодической системой химических элементов Д. И. Менделеева, укажите относительные атомные массы алюминия, хлора, натрия, кислорода, азота.
Решение.
Аг(Аl) =
Аг(Сl) =
Ar(Na) =
Ar(O) =
Ar(N) =
Задача 2. Вычислите относительную молекулярную массу карбоната кальция, имеющего формулу 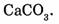
Задача 3. Вычислить относительную молекулярную массу молекулы угольной кислоты (H2 СO3) и её массу в г.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|