
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Физика атомного ядра
- Массу заряженной частицы можно измерить при помощи масс-спектрографа (изобретён ассистентом Джозефа Джона Томсона Фрэнсисом Уильямом Астоном).
Принцип действия масс-спектрографа основан на способности магнитного поля отклонять движущуюся заряженную частицу от прямолинейной траектории (сила Лоренца). Масса определяется
по величине измеренного радиуса траектории частицы – чем легче частица, тем меньше радиус траектории.
Масс-спектрограф представляет собой вакуумную камеру между полюсами магнита, в которой электрическим полем разгоняется заряженная частица. Описав часть окружности, частица врезается в люминофор, который реагирует вспышкой. 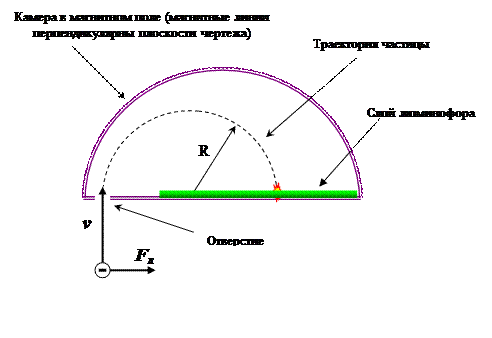 Сила Лоренца является центростремительной силой и уравнение Ньютона (II закон механики) запишется в виде:
Сила Лоренца является центростремительной силой и уравнение Ньютона (II закон механики) запишется в виде:
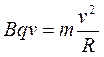 ,
,
откуда масса заряженной частицы равна:
.
Физика атомного ядра
План.
1.Заряд ядра.
2.Состав ядра.
3.Изотопы.
4.Ядерные силы.
5.Энергия связи нуклонов ядра.
6.Масса атомного ядра.
1.Заряд ядра был точно измерен английским физиком Генри Мозли в 1913 г. по спектрам рентгеновского излучения, испускаемого атомами при облучении вещества потоком быстрых электронов.

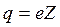 , где
, где
q – заряд ядра, Z – порядковый номер в таблице Менделеева, е – заряд электрона, равный по модулю заряду протона.
Заряд ядра определяет химические свойства, т.к. количество электронов определяется кол-вом протонов, а именно валентные электроны влияют на способность атома вступать в те или иные химические связи, т.е. определяют химические свойства.
2.В 1932 г. Джеймс Чедвик открыл нейтральные частицы ядра – нейтроны, после чего Иваненко и Гейзенберг выдвинули гипотезу о протонно-нейтронном составе ядра. Нейтроны и протоны, составляющие ядро, называют нуклонами (нуклеа – ядро). Масса протона примерно равна массе нейтрона. Количество протонов и нейтронов в ядре – есть массовое число или относительная атомная масса:
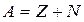 , где
, где
А – массовое число (относительная атомная масса), Z – число протонов, N – число нейтронов.
Атом или атомное ядро химического элемента обычно обозначается
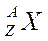 , где Х – какой-либо химический элемент.
, где Х – какой-либо химический элемент.
Например 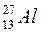 - ядро атома алюминия имеет 13 протонов и 27 – 13 = 14 нейтронов.
- ядро атома алюминия имеет 13 протонов и 27 – 13 = 14 нейтронов.
3.Из таблицы Менделеева следует, что относительная атомная масса в основном выражается дробным числом, тогда как количество нуклонов дробным не бывает. Это объясняется тем, что химический элемент представлен атомами, ядра которых могут содержать различное количество нейтронов. Такие ядра – с равным кол-вом протонов, но различным кол-вом нейтронов называют изотопами. Химически изотопы неразличимы, физически – изотопы отличаются друг от друга. Во-первых, массой, во-вторых, способностью к радиоактивному распаду и его параметрами. Могут наблюдаться и другие отличия. Например, изотоп урана 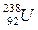 альфа радиоактивен, а изотоп урана
альфа радиоактивен, а изотоп урана 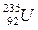 - способен к реакции деления при захвате нейтрона.
- способен к реакции деления при захвате нейтрона.
4.Модель Резерфорда, так же как и модель Томсона не объясняет устойчивость положительных частиц в ядре (между ними действуют кулоновские силы отталкивания). Это противоречие устраняется введением ещё одного типа взаимодействий (кроме гравитационного и электромагнитного) – ядерного, которое также называют сильным взаимодействием. Итак, между нуклонами в ядре действуют ядерные силы, которые и удерживают его от распада. Ядерные силы короткодействующие. Механизм их действия объяснён открытием в 1947 г. π-мезона (частица массивнее электрона в 200раз). Нуклоны в ядре постоянно обмениваются π-мезоном (как заряженные частицы обмениваются фотоном).
5.Точные измерения масс атомных ядер показали, что масса любого ядра меньше суммы масс нуклонов в несвязанном состоянии, из которых это ядро состоит:
mя < Zmp + Nmn.,
т.е. имеет место так называемый дефект массы. Если учесть, что масса есть мера энергии тела (Ео = mc2), то энергия ядра меньше энергии нуклонов, из которых оно состоит. Разность этих энергий называют энергией связи нуклонов в ядре. Именно такую энергию необходимо затратить, чтобы, преодолев ядерные силы, «разодрать» ядро на нуклоны. Верно и обратное – при воссоединении нуклонов в ядро энергия связи выделяется (в виде кинетической энергии). Энергию связи можно рассчитать по формуле: Есв = Δm·с2.
Если дефект массы взять в атомных единицах массы (а.е.м.), то энергию связи в МэВ можно рассчитать по формуле:
Есв = Δm·931,5.
Удельной энергией связи называют энергию, приходящуюся на один нуклон ядра:

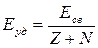 .
.
При расчёте дефекта массы необходимо учесть, что из суммы масс отдельных нуклонов нужно вычитать массу именно ядра данного элемента, а не массу нейтрального атома (куда входит и масса электронов). Во многих таблицах приводится масса нейтральных атомов и при расчёте необходимо вычесть из этой массы массу электронов (количество которых равно количеству протонов в ядре, разумеется).
Пример. Рассчитать энергию связи и удельную энергию связи ядра изотопа лития 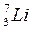 . Из таблицы выписываем массу атома (нейтрального, т.е. с электронами), массу протона, массу нейтрона и массу электрона в а.е.м.
. Из таблицы выписываем массу атома (нейтрального, т.е. с электронами), массу протона, массу нейтрона и массу электрона в а.е.м.
|
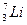
Z = 3 (протоны)
N = 4 (нейтроны)
ma = 7,01601 а.е.м.
mp = 1,00728 а.е.м.
mn = 1,00867 а.е.м.
me = 5,486·10-4 а.е.м.
 |
Eсв - ? Еуд - ?
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|