
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Лекция_Окислительные повреждения белков_Часть-2
Лекция_Окислительные повреждения белков_Часть-2
Фрагментация полипептидных цепей
Процесс фрагментации белков инициируется гидроксильным или гидропероксильным радикалами путем отрыва водорода у α-углеродного атома полипептидного остова молекулы с локализацией на этом атоме свободной валентности. Причем, α-углеродный атом в составе полипептидной цепи (но не у свободных аминокислот) является одним из главных участков молекулы для атаки активными радикалами. Для осуществления свободнорадикального расщепления полипептидной цепи обязательным условием является наличие в среде кислорода. Общая схема фрагментации белка при комбинированном действии гидроксильного радикала и молекулярного кислорода может быть представлена в следующем виде (где R2 - боковая группировка аминокислоты у атакуемого α-углеродного атома):

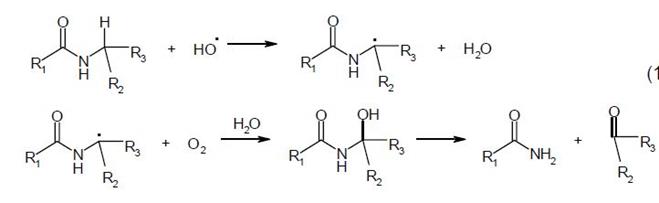
В аэробных условиях, но уже при участии О2-•, атака полипептидной цепи гидроксильным радикалом ведет к образованию пероксирадикальных интермедиатов, облегчающих расщепление пептидных связей до амидного и карбонильного пептидов. Механизм этого процесса предложен Гаррисоном (1962 г):

Образование гидропероксида аминокислотного остатка происходит и в результате непосредственного взаимодействия супероксидного радикала с радикалом на α-углеродном атоме. Наблюдается конкуренция между молекулярным кислородом и НО2• за радикальный центр, что не отражается на конечном результате - расщеплении полипептидного остова белка.
Механизм фрагментации полипептидных структур может включать и стадию образования алкоксильных радикалов (RО•) на α-углеродном атоме. В этом случае α-С-гидропероксид, в присутствии ионов железа и меди разлагается на α-С-алкоксильный радикал с выделением НО-. Радикалы этого типа вызывают быструю реакцию расщепления полипептидного остова (константа скорости которой составляет около 107 с-1) в участке между α-углеродом и углеродом карбонила с образованием радикала •С(О)NHR. Если же α-С-радикал принадлежит С-концевому остатку - наблюдается реакция декарбоксилирования с выделением анион-радикала СО2-•. Последний очень быстро окисляется молекулярным кислородом до СО2 с образованием супероксидного радикала (k = 4.2⋅109 М-1с-1). В случае же локализации свободной валентности на α-С-атоме N-концевого остатка полипептидной цепи - освобождается •С(О)NН2-радикал. Обобщенную схему окислительного разложения полипептидных цепей под воздействием АФК можно изобразить в виде схемы (1).
Оба пути окислительной фрагментации полипептидного остова белка, (а) и (б), являются равноценными и осуществляются в аэробных условиях параллельно. Особо подвержены окислительному разложению пептидные ацилпролиновые связи, чувствительные к окислительной атаке О2-•. Обусловлено это более легким окислением третичной амидной связи, чем вторичной, которую формируют другие аминокислотные остатки.
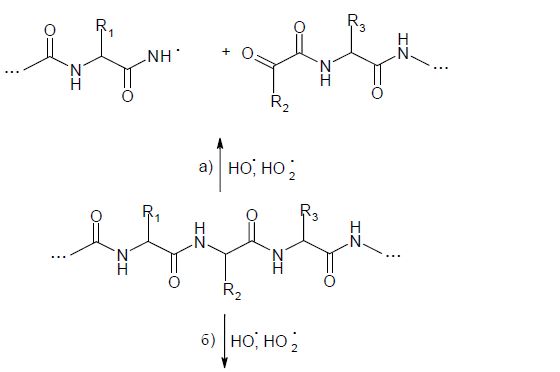
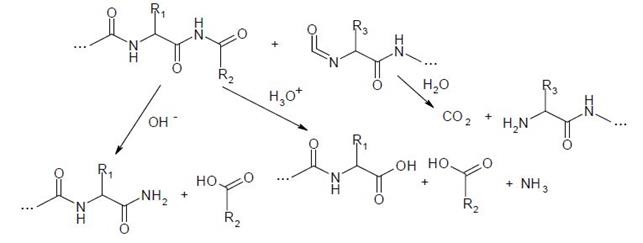
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|