
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Лекция_термодинамический анализ превращения пировиноградной в молочную кислоту
Лекция_термодинамический анализ превращения пировиноградной в молочную кислоту
Термодинамический анализ процессов окисления восстановления можно выполнить, используя значения редокс-потенциалов. Рассмотрим реакцию окисления лактата в пируват с сопряженным восстановлением НАД+.
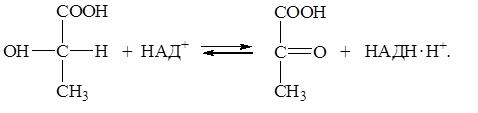
| (1) |
Эту реакцию катализирует фермент лактатдегидрогеназа. Однако мы помним, что в данном случае фермент не влияет на значения термодинамических потенциалов, а лишь ускоряет наступление равновесия. Распишем отдельно прямую и обратную реакции применив уравнение Нернста для каждой редокс-пары:
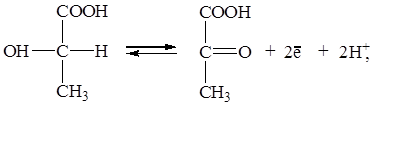
| (2) |
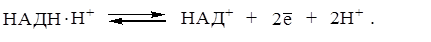
| (3) |
Запишем значение редокс-потенциала для пар пируват / лактат и кофактор окисленный / кофактор восстановленный:

| (4) |

| (5) |
Будет ли процесс окисления лактата в пируват идти самопроизвольно? В качестве окислителя предполагается НАД+, следовательно, ЭДС пары НАД+/НАДН∙Н+ должно быть больше, чем пары пируват/лактат:
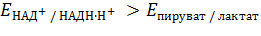
| (6) |
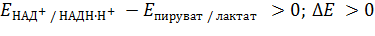
| (7) |
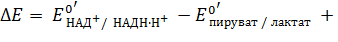
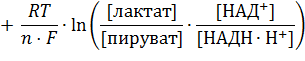
| (8) |
Допустим, при рН 7,0 и температуре 310 К концентрации веществ такие:
1) 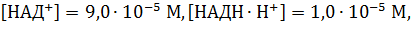
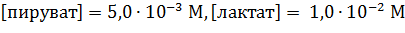
|
После подстановки значений стандартных редокс-потенциалов, взятых из таблицы, представленной в прошлой лекции, и концентраций участвующих в реакции метаболитов:
 38,6 > 0 38,6 > 0
|
Таким образом, получили положительное значение редокс-потенциала. Это означает, что при данных концентрационных условиях окисленная форма НАД+ выступает в качестве окислителя, а лактат в качестве восстановителя и реакция до наступления равновесных концентраций идет в направлении от лактата к пирувату.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|