
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
а А + в В = f C + d Д. DН0х.р. = å D Н0обр.прод. ¾ å D Н0обр.исх.в-в. DН0х.р. = (f D Н0с + d D Н0Д ) - (а D Н0А + в D Н0В ), Кдж.. только вместо D Н0с D Н0Д D Н0А D Н0В записываем свои конкретные соединения.. f d d в - это коэффициенты
Лекция №3
Тема: «Пересчет тепловых эффектов химических реакций на реальные количества веществ»
Цель работы: 1. Закрепить теоретические знания по теме:
“Первый закон термодинамики”.
2. Научиться пересчитывать тепловые эффекты химических реакций
на реальные количества веществ.
3. Подготовиться к курсовому проектированию (выполнению
теплового баланса агрегата)
ПРАКТИЧЕСКАЯ РАБОТА
Ход работы
I. Рассчитать по закону Гесса с использованием справочной литературы тепловые эффекты предложенных химических реакций
а А + в В = f C + d Д
DН0х.р. = å D Н0обр.прод. ¾ å D Н0обр.исх.в-в
DН0х.р. = (f D Н0с + d D Н0Д ) - (а D Н0А + в D Н0В ), Кдж.
Расчёт выполняется следующим образом (напоминание и лекции №2)
1. Записываем уравнение реакции
2.Выписываем значение энтальпий из справочных данных (смотрите таблицы энтальпий)
например: не забывайте смотреть знак, все данные со знаком «-»
DН0CuS = - , кДж/моль
DН0FeS = -
DН0Cu2O = -
3 Затем записываем формулу
DН0х.р. = (f D Н0с + d D Н0Д ) - (d D Н0А + в D Н0В ),
только вместо D Н0с D Н0Д D Н0А D Н0В записываем свои конкретные соединения.
f d d в - это коэффициенты перед вашими соединениями
4. Затем подставляем данные в уравнение DН0х.р. =
5. Не забывает про все математические действия с отрицательными значениями
6. Если что-то непонятно - задаём вопросы
II. Пересчитать полученный тепловой эффект химической реакции на заданные количества исходных веществ или продуктов реакции.
При пересчете на заданный объем газообразного вещества пользоваться следствием закона Авогадро. (1киломоль любого газа занимает объём 22,4 м3)
Пересчёт ведётся следующим образом:
1. В ходе выполнения расчёта, получаем данные по тепловому эффекту реакции на количество моль данного вещества (т.е. грамм, которые определяем по молекулярной массе вещества). Например, для FeS
Fe - 55,85 г/моль S -32,00 г/моль
Для 1 моль масса FeS
mFeS: 1*(55,85 г/моль + 32,00 г/моль) = 87,85г
2. Это означает, что если в реакцию вступает такое количество FeS (87,85грамм), то количество тепла выделяется (поглощается), согласно расчёта.
3. Затем делается пересчёт на заданное количество по пропорции
mFeS Qхимюреакци
m: 87,85г Значение расчёта, кДж
mзаданная Q
Q = 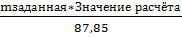
Не забываем, что масса в граммах, а задаётся масса в килограммах, т.е. в 103 раз больше. Переводим в одни единицы.
III. Сделать вывод, является реакция экзо - или эндотермической
зная, что D Н0х.р. = -Q0х.р.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|