
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Тема: Основные положения молекулярно-кинетической теории и их опытное обоснование
Тема: Основные положения молекулярно-кинетической теории и их опытное обоснование
Цели: познакомить учащихся с основными положениями молекулярно-кинетической теории и их опытными подтверждениями, с величинами, характеризующими молекулы (размеры и массы молекул, количество вещества, постоянная Авогадро) и методами их измерения; развивать внимание, логическое мышление учащихся, воспитывать добросовестное отношение к учебному труду
Тип урока: урок усвоения новых знаний
Ход урока
1. Организационный момент
2. Постановка цели урока
3. Изложение нового материала
Молекулярно-кинетическая теория зародилась в XIX в. с целью объяснить строение и свойства вещества на основе представления о том, что вещество состоит из мельчайших частиц – молекул, которые непрерывно движутся и взаимодействуют друг с другом. Особых успехов эта теория достигла при объяснении свойств газов.
Молекулярно-кинетической теорией называют учение, которое объясняет строение и свойства тел движением и взаимодействием частиц, из которых состоят
тела.
В основе МКТ лежат три важнейших положения:
1. все вещества состоят из молекул;
2. молекулы находятся в непрерывном хаотическом движении;
3. молекулы взаимодействуют друг с другом.
Предположение о молекулярном строении вещества подтверждалось только косвенно. Основные положения МКТ газов хорошо согласовывались с экспериментом. Сегодня техника достигла уровня, при котором можно рассмотреть даже отдельные атомы. Убедиться в существовании молекул и оценить их размер можно довольно просто.
Поместим капельку масла на поверхность воды. Масляное пятно будет растекаться по поверхности воды, но площадь масляной плёнки не может превышать определённого значения. Естественно предположить, что максимальная площадь плёнки соответствует масляному слою толщиной в одну молекулу.
Убедиться в том, что молекулы движутся, можно совсем просто: если капнуть капельку духов в одном конце комнаты, то через несколько секунд этот запах распространится по всей комнате. В окружающем нас воздухе молекулы двигаются со скоростями артиллерийских снарядов – сотни метров в секунду. Удивительным свойством движения молекул является то, что оно никогда не прекращается. Этим движение молекул существенно отличается от движения окружающих нас предметов: ведь механическое движение неизбежно прекращается вследствие трения.
В начале XIX в. английский ботаник Броун, наблюдая в микроскоп частицы пыльцы, взвешенные в воде, заметил, что эти частицы пребывают в «вечной пляске». Причину так называемого «броуновского движения» поняли только через 56 лет после его открытия: отдельные удары молекул жидкости о частицу не компенсируют друг друга, если эта частица достаточно мала. С тех пор броуновское движение рассматривается как наглядное опытное подтверждение движения молекул.
Если бы молекулы не притягивались друг к другу, не было бы ни жидкостей, ни твёрдых тел – они просто бы рассыпались на отдельные молекулы. С другой стороны, если бы молекулы только притягивались, они бы превращались в чрезвычайно плотные сгустки, а молекулы газов, ударяясь о стенки сосуда, прилипали бы к ним. Взаимодействие молекул имеет электрическую природу. Хотя молекулы в целом электрически нейтральны, распределение положительных и отрицательных электрических зарядов в них таково, что на больших расстояниях (по сравнению с размерами самих молекул) молекулы притягиваются, а на малых расстояниях – отталкиваются. Попробуйте разорвать стальную или капроновую нить диаметром 1 мм2. Вряд ли это удастся, даже если приложить все силы, а ведь усилиям вашего тела противостоят силы притяжения молекул в малом сечении нити.
Параметры газа, связанные с индивидуальными характеристиками составляющих его молекул, называются микроскопическими параметрами(масса молекул, их скорость, концентрация).
Параметры, которые характеризуют состояние макроскопических тел, называют макроскопическими параметрами (объём, давление, температура).
Основная задача МКТ – установить связь между микроскопическими и макроскопическими параметрами вещества, исходя из этого, найти уравнение состояния данного вещества.
Например, зная массы молекул, их средние скорости и концентрации, можно найти объём, давление и температуру данной массы газа, а также определить давление газа через его объём и температуру.
Обычно в основе построения любой теории лежит метод моделей, заключающийся в том, что вместо реального физического объекта или явления рассматривают его упрощённую модель. В МКТ газов используется модель идеального газа.
С точки зрения молекулярных представлений, газы состоят из атомов и молекул, расстояния между которыми значительно больше их размеров. Вследствие этого силы взаимодействия между молекулами газов практически отсутствуют. Взаимодействие между ними фактически происходит лишь во время их столкновений.
Поскольку взаимодействие молекул идеального газа сводится лишь к кратковременным столкновениям и размеры молекул не влияют на давление и температуру газа, мы можем считать, что
Идеальный газ – это модель газа, которая предусматривает пренебрежение размерами молекул и их взаимодействием; молекулы такого газа находятся в свободном беспорядочном движении, иногда сталкиваясь с другими молекулами или стенками сосуда, в котором они находятся.
Реальные разрежённые газы ведет себя подобно идеальному газу.
Примерную оценку размеров молекул можно получить из опытов, проведённых немецким физиком Рентгеном и английским физиком Рэлеем. Капелька масла на поверхности воды расплывается, образуя тонкую плёнку толщиной всего лишь в одну молекулу. Толщину этого слоя нетрудно определить и тем самым оценить размеры молекулы масла. В настоящее время существует ряд методов, позволяющих определить размеры молекул и атомов. Например, линейные размеры молекул кислорода составляют 3 · 10-10 м, воды – около 2,6 · 10-10 м. Таким образом, характерной длиной в мире молекул является размер 10-10 м. Если молекулу воды увеличить до размеров яблока, то само яблоко станет диаметром с земной шар.
В прошлом веке итальянский учёный Авогадро обнаружил удивительный факт: если два различных газа занимают сосуды одинакового объёма при одинаковых температурах и давлениях, то в каждом сосуде находится одно и то же число молекул. Заметьте, что массы газов при этом могут сильно отличаться: например, если в одном сосуде водород, а в другом – кислород, то масса кислорода в 16 раз больше массы водорода.
Это означает. Что некоторые, причём довольно важные, свойства тела определяются числом молекул в этом теле: число молекул оказывается даже более существенным, чем масса.
Физическая величина, определяющая число молекул в данном теле, называется количеством вещества и обозначается 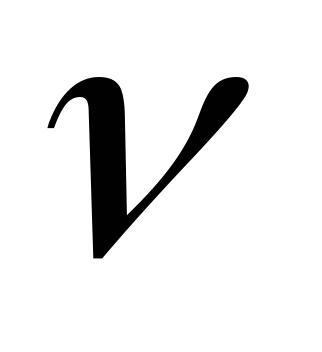 . Единицей количества вещества является моль.
. Единицей количества вещества является моль.
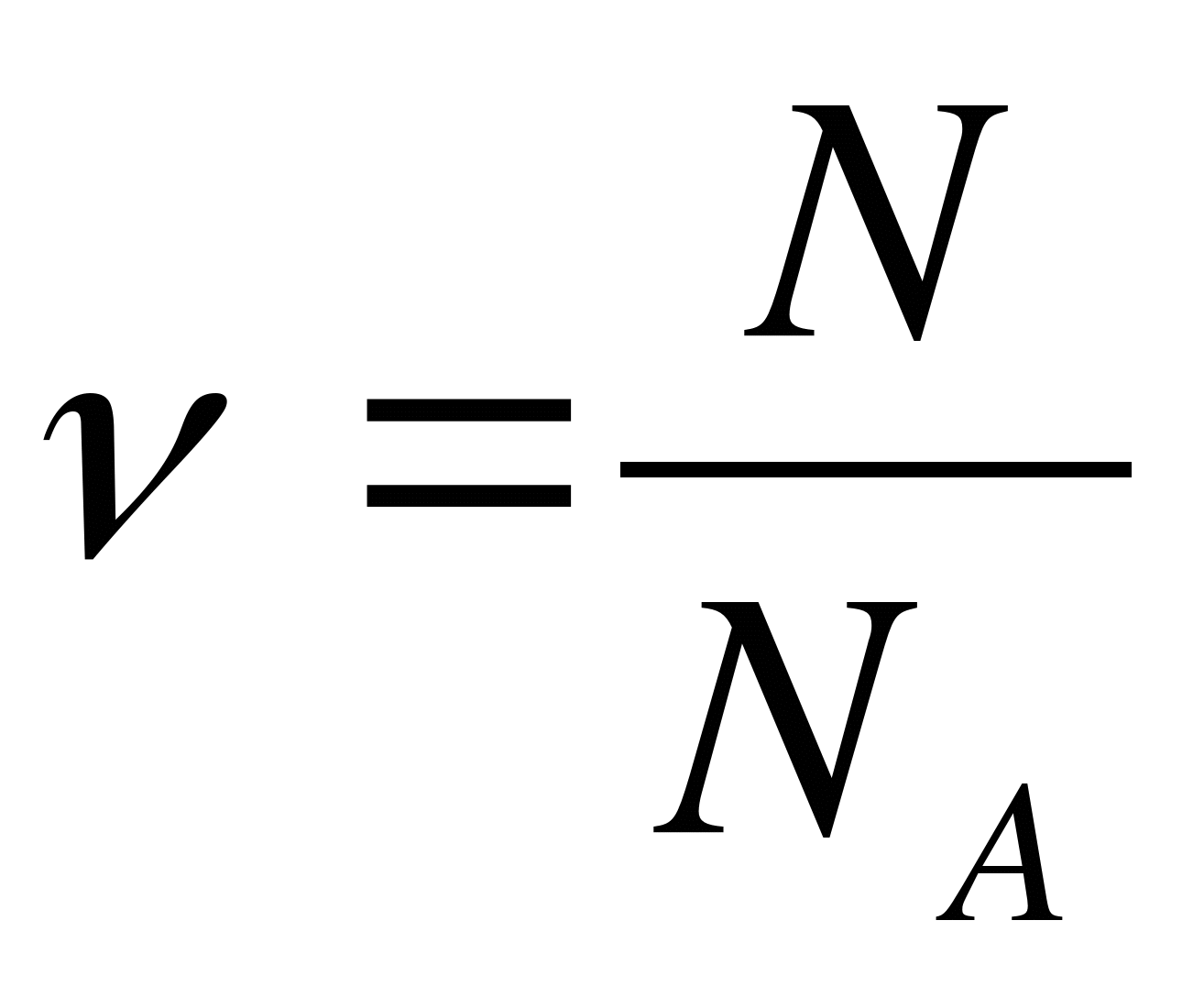
Так как массы отдельных молекул отличаются друг от друга, то одинаковые количества разных веществ имеют разную массу.
1 моль – это количество вещества, которое содержит столько же молекул, сколько атомов углерода содержится в 0,012 кг углерода.
Массы отдельных молекул очень малы. Потому удобно использовать при расчётах не абсолютные, а относительные значения масс. По международному соглашению массы всех атомов и молекул сравнивают с 1/12 массы атома углерода. Главная причина такого выбора состоит в том, что углерод входит в большое число различных химических соединений.
Относительной молекулярной (или атомной) массой вещества Мназывается отношение массы молекулы (или атома) m0 данного вещества к 1/12 массы атома углерода:
Mг = 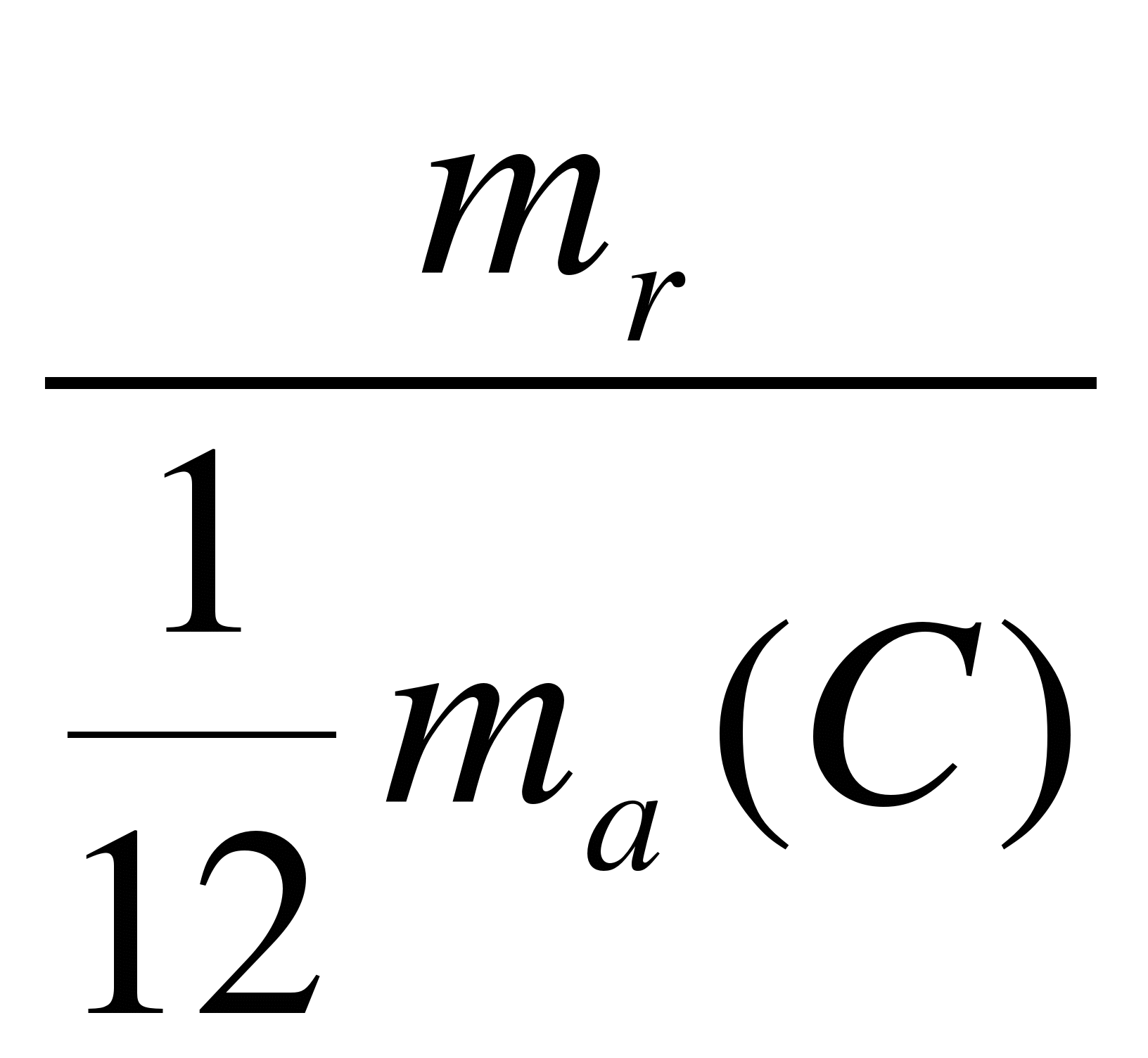
mr - масса молекулы данного вещества;
mа(C) - масса атома углерода 12C.
Например, относительная атомная маса углерода равна 12, водовода – 1. Относительная же молекулярная маса водовода 2, поскольку молекула водорода состоит из двух атомов.
Удобство выбора моля в качестве единицы измерения количества вещества связано с тем, что маса одного моля вещества в граммах численно равна его относительной молекулярной массе.
Маса m тела пропорциональна количеству вещества 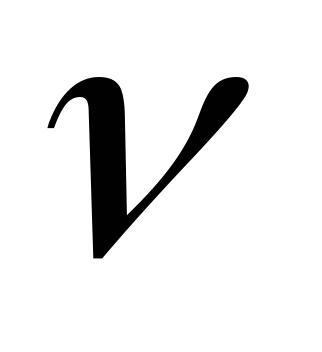 , содержащемуся в этом теле. Поэтому отношение
, содержащемуся в этом теле. Поэтому отношение  характеризует вещество, из которого состоит это тело: чем «тяжелее» молекулы вещества, тем больше это отношение.
характеризует вещество, из которого состоит это тело: чем «тяжелее» молекулы вещества, тем больше это отношение.
Отношение массы вещества m к количеству вещества 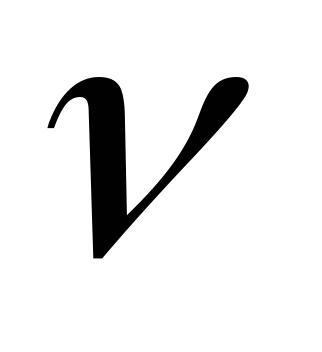 называетсямолярной массой и обозначается М:
называетсямолярной массой и обозначается М:
М = 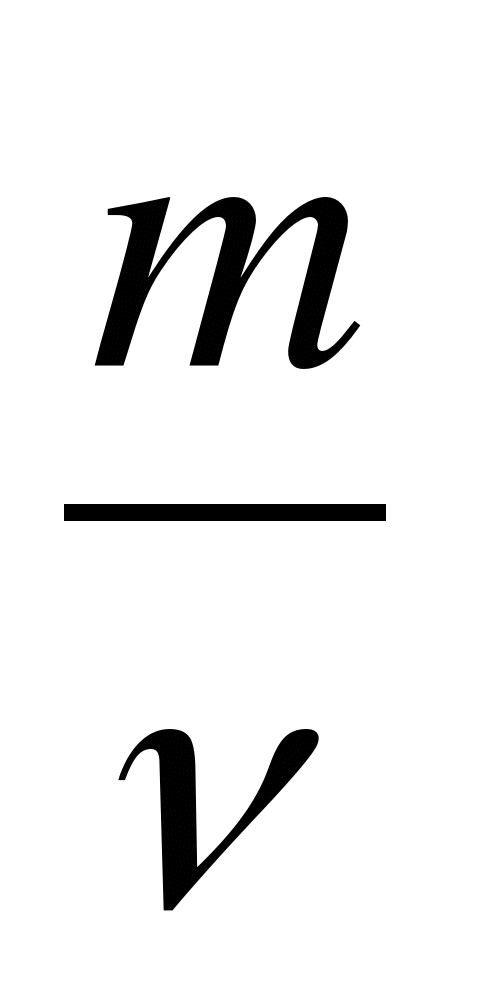
Если принять в этой формуле 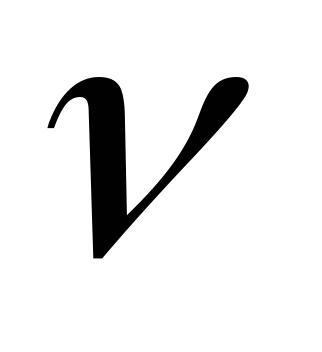 =1, получим, что молярная масса вещества численно равна массе одного моля этого вещества. Например, масса водорода равна
=1, получим, что молярная масса вещества численно равна массе одного моля этого вещества. Например, масса водорода равна
2 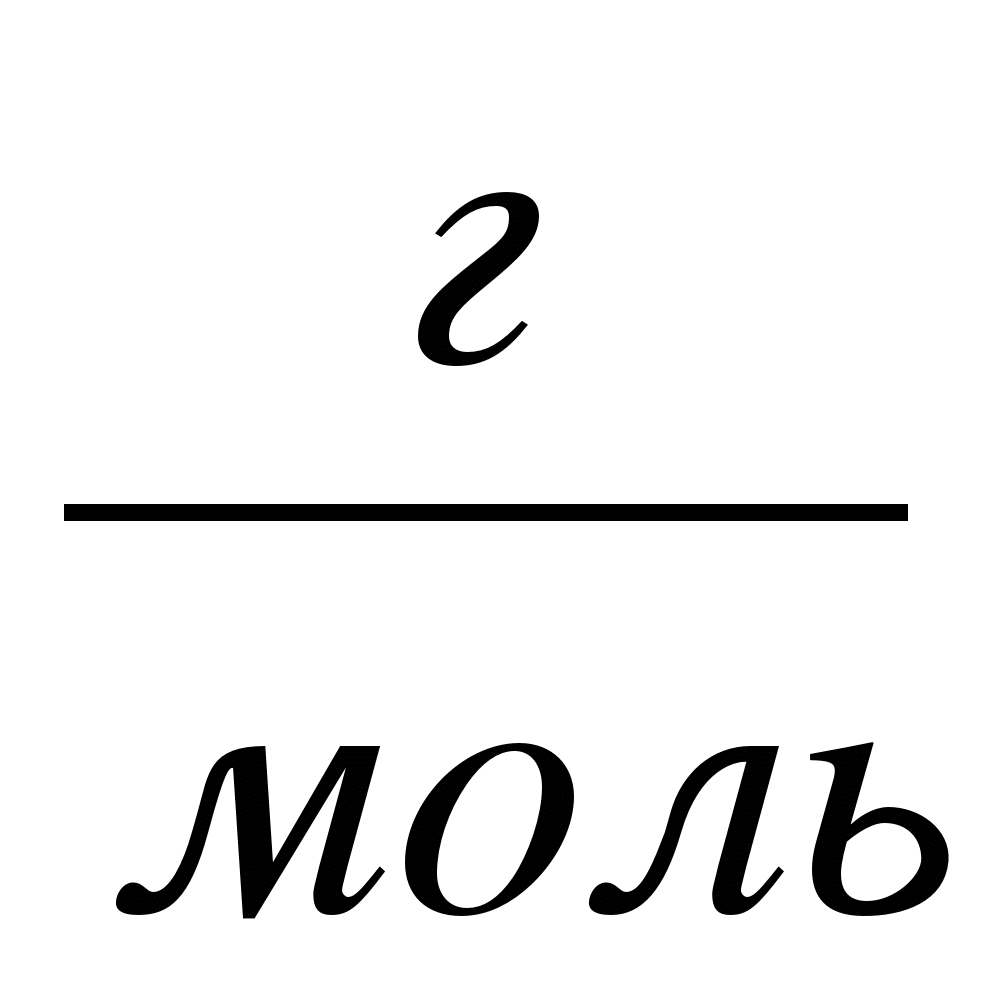 = 2 · 10-3
= 2 · 10-3 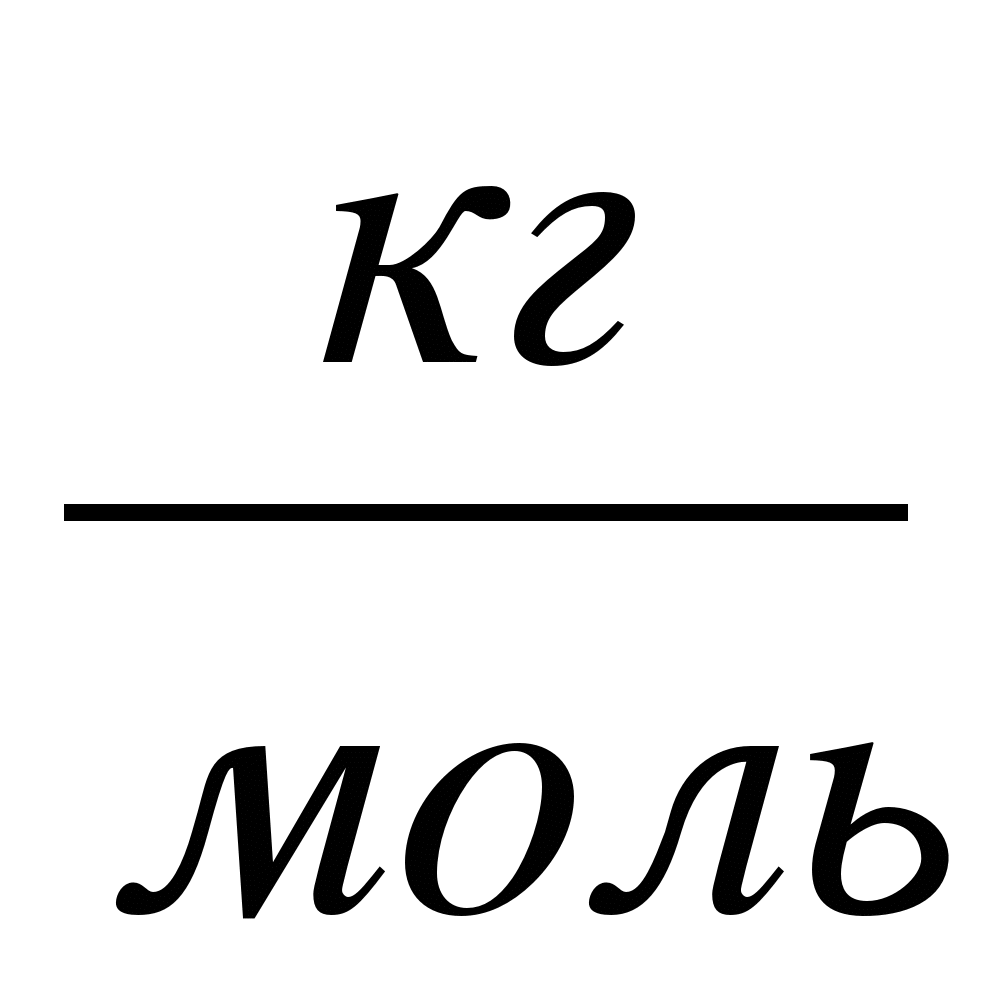 .
.
1 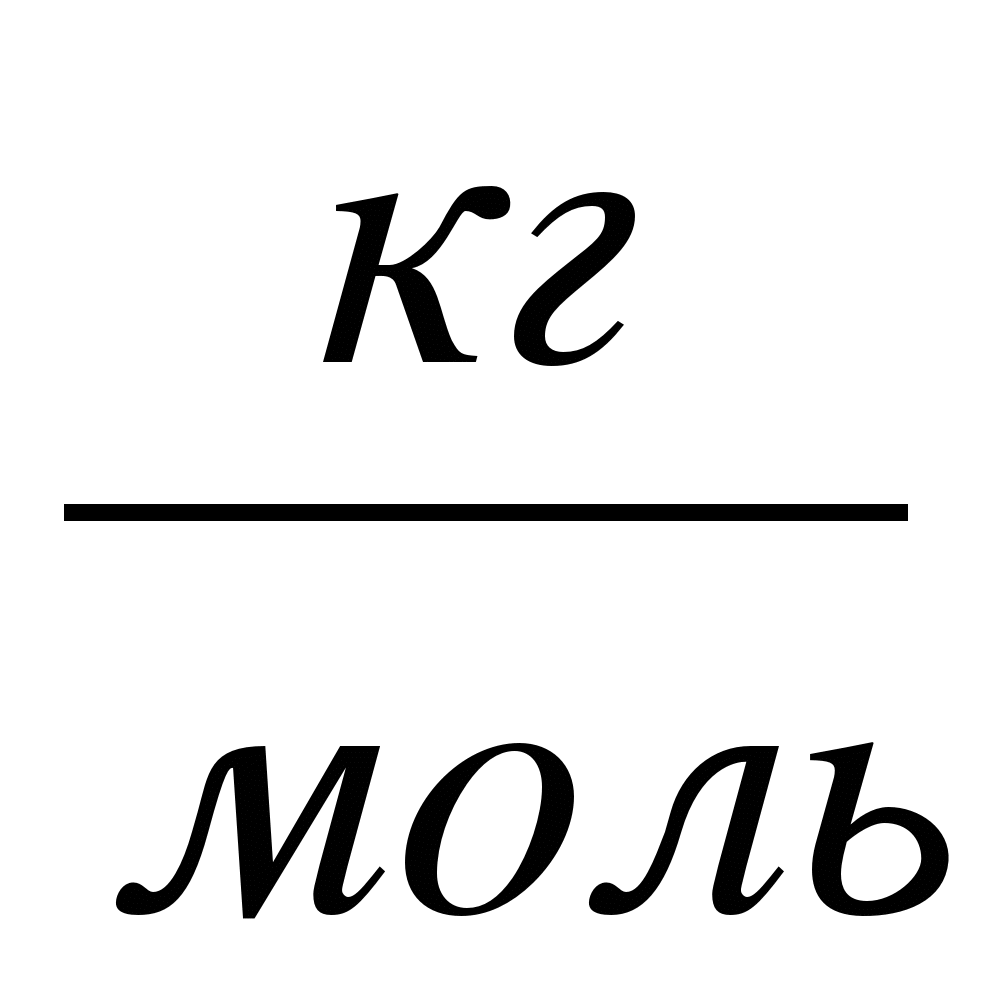 - единица измерения молярной массы в СИ.
- единица измерения молярной массы в СИ.
Масса вещества m = 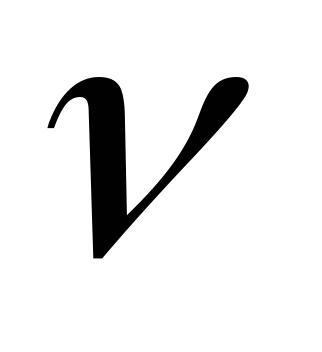 M.
M.
Число N молекул, содержащихся в теле, прямо пропорционально количеству
вещества 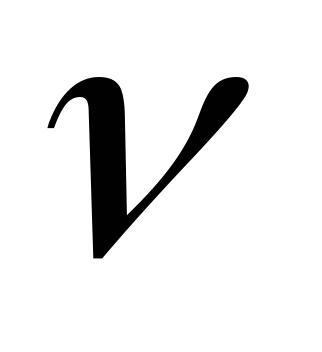 , содержащегося в этом теле.
, содержащегося в этом теле.
Коэффициент пропорциональности является постоянной величиной и называется постоянной Авогадро NA
Откуда следует, что постоянная Авогадро численно равна числу молекул в 1 моле.
Постоянная Авогадро была получена многими способами. В результате получили значение
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|